Личинка — залог безопасности вашего жилья
Содержание: 1. Что такое личины для замков 2. Выбор личинки замка двери 3. Виды личинок для дверных замков 4. Как разобрать личинку замка двери 5. Как снять личинку замка двериЧто такое личины для замков
Личина представляет собой секретный механизм с уникальной резьбой внутри замка. Личина — это и есть та часть, в которую вставляется ключ. С её помощью замок открывают/закрывают. Если хотя бы одно деление ключа не сойдётся с механизмом личины, то замок не откроется. Это — его главный секрет. Чем прочнее, разнообразнее личина, тем выше степень защищённости помещения.
Выбор личинки замка двери
К выбору дверного замка нужно подойти особенно серьёзно. Именно от его личины зависит прочность и подверженность взлому. Некоторые производители, заботясь о безопасности людей, делают ложные накладки на прорези, куда вставляется ключ, делают неудобной замочную скважину, создавая внутренние барьеры, тем самым усложняя задачу квартирным ворам. Чем сложнее и изворотливее механизм личинки, тем более он устойчив к взлому.
Выбирая личину для замков металлической двери, нужно обратить внимание на ее секретность. Чем больше секретных комбинаций содержит механизм, тем выше его надёжность. Зная особенности видов личин, можно выбрать наилучший вариант дверных замков.
Виды личинок для дверных замков
Личинки для дверных замков подразделяются на следующие виды:
- Дисковые;
- Крестовидные;
- Штифтовые;
- С повышенной сложностью главного механизма.
Данные типы личины имеют цилиндровую форму механизма. Преимуществом такого вида является то, что её можно легко заменить, не причиняя вреда замку, не повреждая при этом само дверное полотно.
Дисковые
Дисковые личины состоят из дисков, которые при вращении ключа под определённым градусом оставляют пространство для освобождения механизма. У данного устройства плюс в том, что при открывании/закрывании двери очень сложно будет сломать ключ. Такие замки отлично подойдут для общественных помещений, на двери которых в течение дня осуществляется большая нагрузка.
Такие замки отлично подойдут для общественных помещений, на двери которых в течение дня осуществляется большая нагрузка.
Крестовидные
Крестовидный механизм имеет в своей личине пины, которые при вращении ключа располагаются по всем его граням. Они [грани] имеют небольшое количество комбинаций, что не защитит на 100 % от взлома, так как разбирается замок одной отверткой. Данный тип механизма является одним из самых низко устойчивых ко вскрытию, поэтому он уже выходит из употребления. В продаже он встречается в основном только в качестве бракованных замков.
Штифтовые
У штифтового механизма имеется внутри опорная конструкция, носящая одноимённое название, которая при вставке ключа вдавливается, подстраиваясь под подходящую для неё резьбу. Замки с данным видом механизма окружают нас повсюду: в квартирах, автомобилях, офисах, магазинах.
С повышенной сложностью главного механизма
Замки с повышенной сложностью механизма — название говорит само за себя. С каждым годом производители изобретают всё более сложные устройства, даря нам комфортное нахождение дома в любое время.
При выборе дверного замка или же отдельной личинки для замены нужно обращать внимание на производителя, на страну изготовления. Самыми лучшими странами-производителями являются: Италия, Германия, Австрия, Турция, некоторые предприятия России.
Часть производителей производит замки, которые не удалось бы открыть даже с помощью бампингового ключа, устанавливая внутри механизма отталкивающие магнитные устройства. От вида личины зависит возможность её разборки и замены.
Как разобрать личинку замка двери
Случается бывает, что кто-то из членов семьи потерял ключ от двери, либо замок вышел из строя. В целях безопасности рекомендуется менять замки. Но на самом деле в большинстве случаев достаточно лишь сменить личинку, чтобы снова спать спокойно. От вида замка зависит, возможно ли его разобрать самостоятельно или же придётся прибегнуть к помощи специалистов.
Для того чтобы разобрать большинство замков, понадобится всего лишь отвёртка с крестовым разъёмом. Ей нужно выкрутить винтик, который соединяет личину с замком. Затем вставить ключ и им подцепить личину, чтобы её извлечь. Если нужно заменить личину, то в образовавшееся отверстие просто следует вставить новую и прикрутить открученный болт обратно. Прикрутить нужно так, чтобы винт был в исходном состоянии, как до разбора; при недостаточном или, напротив, сильном прикручивании устройство может быстро выйти из строя. При этом чтобы заменить личину, нужно принести старую в магазин, чтобы там подобрали аналогичное устройство нужных размеров и параметров. Это позволит сэкономить время на лишние походы — если вы будете измерять её самостоятельно, она может вдруг оказаться неподходящего размера.
Однако, не всегда дверные замки требуют разбора для ремонта или замены личины. Ведь любая вещь со временем изнашивается, если не уделять ей должного внимания. Иногда механизм начинает немного заклинивать, либо ключ плохо проворачивается или же появляется неприятный звук при открывании двери. В этом случае не нужно сразу идти в магазин за новым замком. Рекомендуем попробовать смазать его специальным маслом, чтобы подарить затвору вторую жизнь. Для этого нужно в прорезь замка налить требуемое количество чистящего средства, удалить излишки, вставить ключ и несколько раз провернуть его в разные стороны. Такая процедура очистит механизм от пыли и грязи и станет подготовительным шагом к заливке масла. Далее в прорезь необходимо залить несколько капель смазочного масла и снова несколько раз повернуть ключ. Если же этот способ не сработал, скорее всего, механизм либо сам замок нуждается в замене.
Как снять личинку замка двери
Снять личинку с замка двери можно в том случае, если она цилиндрического вида. Штифтовые тоже получится снять самостоятельно, но придётся потратить на это больше времени. В остальных случаях проще будет поменять весь замок.
Если есть ключ, снятие личинок занимает несколько минут. Но что делать, если ключа нет, а дверь нужно срочно открыть? Задача довольно непростая, но всё же решаемая.
Можно попробовать выбить личину, используя молоток и зубила. Под действием тяжести ударов механизм выгнется после чего выскочит наружу. Однако после данного способа придётся полностью менять замок, а возможно, и само дверное полотно.
Но что делать, если ключа нет, а дверь нужно срочно открыть? Задача довольно непростая, но всё же решаемая.
Можно попробовать выбить личину, используя молоток и зубила. Под действием тяжести ударов механизм выгнется после чего выскочит наружу. Однако после данного способа придётся полностью менять замок, а возможно, и само дверное полотно.
Следующий способ заключается в просверливании личины. Направить сверло нужно прямо в замочную скважину. Секретный механизм под таким воздействием просто вылетит, и дверь можно будет открыть. Конечно, таким способом сохранить личину в целостности не удастся, но вполне реально постараться сохранить невредимой дверь.
Ещё один способ — более безопасный, но слишком кропотливый — это использование бампинг-ключа. Также можно использовать две проволоки: первая — прямая, вторая — с загнутым концом, чтобы по очереди прогибать механизмы в нужном порядке, дабы они встали в одну линию, и таким образом провернуть замочный механизм.
Без реальной необходимости не рекомендуется пользоваться ни одним из перечисленных способов; в случае срочного взлома лучше обратиться в соответствующие организации. Таким образом, личина является очень важной частью как дверного замка, так и замков, используемых для других нужд. Нужно очень ответственно подходить к его выбору, не жалеть денежных средств, обращать внимание на производителя, страну производства. Пренебрегая данными критериями, есть вероятность потерять намного больше. Следует помнить, что все мы живём в крайне опасное время, и статистика взломов дверей не падает. В случае потери ключей следует незамедлительно менять замок или его сердце — личинку. Поэтому тщательное изучение информации по выбору замка поможет сделать правильный выбор и сбережёт дом и имущество от неожиданных визитов воров-взломщиков. А правильный уход обеспечит долгий срок службы замка.
МастерДвери – железные двери в Протвино
Схема дверного замка – как его собрать?
Чем надежнее замок, тем сложнее его конструкция. Данное правило работает далеко не во всех случаях, а в ряде ситуаций происходит с точностью да наоборот. Но одно можно сказать точно, если возникает необходимость собрать или разобрать запирающее устройство, нужна подробная схема дверного замка. В нашей статье мы обсудим особенности сборки дверных замков своими руками, и вы поймете, что данная работа не так сложна, как кажется на первый взгляд.
Данное правило работает далеко не во всех случаях, а в ряде ситуаций происходит с точностью да наоборот. Но одно можно сказать точно, если возникает необходимость собрать или разобрать запирающее устройство, нужна подробная схема дверного замка. В нашей статье мы обсудим особенности сборки дверных замков своими руками, и вы поймете, что данная работа не так сложна, как кажется на первый взгляд.
Готовимся к сборке дверного запирающего устройства
Обычно для того, чтобы установить или починить замок, требуется его сборка и разборка. Перед установкой замок разбирают для того, чтобы убедиться в отсутствии бракованных элементов секретного механизма и для удаления инородных предметов из него. Ну а для того, чтобы осуществить ремонт, без разборки замка обойтись просто невозможно.
Многие обыватели, пытаясь разбирать замок, допускают распространенную ошибку, которая приводит к тому, что собрать воедино все детали устройства они, потом не могут. Казалось бы, что может быть глупее? Но на самом деле, как утверждают специалисты, которым приходится часто общаться с такими «горе-мастерами», такое происходит сплошь и рядом.
Впросак можно попасть даже в том случае, если запирающее устройство было разобрано без демонтажа корпуса с дверного полотна, просто для профилактической чистки механизма от пыли. Стоит не заметить пружинку, случайно вылетевшую из недр секрета и вот вам проблема. Чтобы не сталкиваться с подобными неприятностями не стоит спешить вскрывать корпус замка. Сначала достаньте очень важный предмет под названием схема дверного замка, естественно того, который вы разбираете.
Если схема не шла в комплекте с замком, ее можно раздобыть в сети Интернет. Изучив схему, вы будете знать:
- комплектность элементов, содержащихся в корпусе устройства;
- их расположение;
- о том, как один элемент крепится к другому;
- каковы функции каждого элемента.
Схема запирающего устройства – это далеко не все, что нам может потребоваться для его разборки и сборки. Голыми руками замок не разберешь, нужны инструменты и смазка.
Голыми руками замок не разберешь, нужны инструменты и смазка.
- Отвертки, которые нужно подбирать в соответствии с используемыми в замке крепежными элементами.
- Оригинальный ключ, который потребуется для проверки работоспособности секретного механизма.
- Пинцет, шило и лупа. Инструменты, которые требуются для работы с мелкими деталями.
- Специальная смазка, рекомендуемая производителем, либо WD-40. Также для смазки дополнительно хорошо использовать графитовый порошок.
- В зависимости от целей сборки/разборки нужны: комплектующие к замку для его ремонта, кисточка или пылесос для чистки от пыли и так далее.
Общий порядок сборки/разборки цилиндрового замка
Если не трогать сам цилиндр, то есть секретную часть запирающего устройства, то разобрать такой замок ничего не стоит. Личинки выходят из строя довольно часто и причин тому много, но замену сломавшемуся механизму секретности найти несложно. У большинства цилиндровых замков имеется три важнейших конструкционных элемента:
- корпус;
- ригели;
- личинка.
Сколь мощным бы ни был корпус и ригели замка, они ничто без личинки. Ведь именно личинка представляет собой секретный механизм, который управляет ригелями. Чтобы заменить личинку необходимо открыть дверь и внимательно осмотреть торцевую часть дверного полотна в районе выходных отверстий под ригели. Именно там, скорее всего, находится небольшой крепежный элемент, удерживающий цилиндр в корпусе, чтобы не ошибиться, сверьтесь со схемой.
Важно! Перед тем как выкручивать крепеж личинки, проверьте, чтобы замок был в положении открыто.
Выкрутив крепежный элемент (если он один), для удобства извлечения личинки вставьте ключ в замочную скважину. Затем повернув его немного в сторону, извлеките вместе с личинкой из недр замка. Если личинка не вышла с первого раза, попробуйте ее немного покачать.
Чтобы установить новую личинку, потребуется лишь повторить порядок работы в обратной последовательности.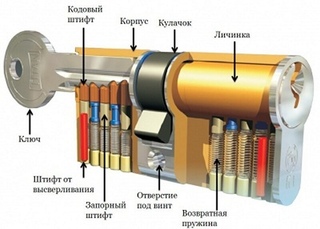
- Вытаскиваем цилиндр из корпуса замка.
- Извлекаем стопорное колечко.
- Засовываем ключ в замочную скважину и поворачиваем его примерно на 180о.
- Двумя спицами фиксируем пины, располагающиеся в нижней части секрета.
- Теперь вынимаем верхние пины и производим необходимые действия.
Разбираем/собираем сувальдный замок своими руками
Секрет сувальдного замка гораздо больше по размеру, чем личинка цилиндрового запирающего устройства. Получить доступ к элементам секрета гораздо проще, а значит собрать и разобрать до конца подобный замок можно без специальных инструментов. Однако перед демонтажем секрета сверьтесь со схемой, ведь положение сувальдных пластин в разных замках может отличаться.
Чтобы разобрать сувальдный замок нужно подготовить отвертку, подходящую смазку и ветошь. Прежде всего, выкручиваем крепежные элементы, удерживающие крышку корпуса замка. Снимаем крышку, обнажая тем самым секретный механизм и остальные элементы, находящиеся в корпусе. Нас будет интересовать подпружиненная стопка металлических пластин с причудливыми вырезами, это и есть секрет замка.
Отводим пружины в сторону и извлекаем стопку пластин из корпуса. Обратите внимание, что пластины нанизаны на специальные крепежные элементы и непосредственно соприкасаются со стойкой хвостовика. Благодаря этому собрать пластины как-то иначе довольно трудная задача.
Произведя с пластинами нужные нам манипуляции, собираем секрет обратно. Пластины в стопке располагаются в определенном порядке, изменение этого порядка приведет к перекодировке секрета. Значит нужно собрать пластины в той же последовательности.
Нюансы сборки запирающих устройств – советы специалистов
К сборке замка многие люди относятся достаточно вольно, считая это занятие весьма простым. На самом деле подобная работа скрывает множество подводных камней. Чтобы их обойти, нужно воспользоваться следующими советами специалистов.
- После самостоятельной сборки замка не забывайте проверять его работоспособность, вставив в него ключи.
- Проверяйте расположение элементов внутри замка согласно схеме.
- Не перетягивайте крепежные элементы, это может нарушить работу секрета.
- Сувальды должны крепиться в замке достаточно плотно, если они выпадают, значит, вы сделали что-то не так.
- Обнаружив поврежденные элементы в замке, замените их, если замены не нашлось, меняйте замок. Никогда не устанавливайте неисправное запирающее устройство на дверь.
Если вы задумались о том, как собрать дверной замок схема вам в помощь. Ведь именно схема к конкретному запирающему устройству содержит исчерпывающую информацию, которая необходима вам для успешной его сборки/разборки. Помните также, что далеко не всегда нужно самостоятельно лезть в недра замка и терять время на проблему, которую вы не можете решить. Доверяйте подобную работу специалистам, не будьте скупы.
Как собрать замок в дверь
Как собрать замок при его ремонте или замене? Необходимость сборки механизма возникают после того, как его разбирали для поиска поломки, чистки или устранения неисправности. Рассмотрим схему сборки одного из популярных типов замков – сувальдных.
Схема замка
Для того, чтобы быстро и правильно собрать любой замок, необходимо знать его компоновку. Это относится к любому типу замков, которых, кроме сувальдных, существует еще несколько. Существуют и используются также цилиндровые, дисковые, ригельные замки. Сборка каждого из них отличается некоторыми нюансами.
Сборка каждого из них отличается некоторыми нюансами.
Сувальдные замки применяются реже цилиндровых, но их компоновка и секрет проще. Любой замок состоит из:
- Основной элемент какого замка – пакет пластин (сувальд) с вырезами, которые при поворачивании ключа отталкиваются его бородками и занимают требуемое положение.
- Пластины двигают язычок, который также входит в состав замка.
- Все обозначенные элементы собираются в стальном корпусе.
Сувальдный замок проще некоторых других типов, но менее надежный.
Порядок сборки
Сувальдный замок легко разбирается, и так же просто собирается. Для начала необходимо проверить наличие всех внутренних компонентов. Основная проблема, которая возникает при сборке сувальдного замка – расположение пакета пластин именно в том порядке, в каком они были собраны на заводе. Если во время сборки их перепутали, то существующий ключ не подойдет к используемому замку.
Чтобы избежать этой проблемы, при разборке необходимо записывать или запоминать расположение каждой пластины. Сам процесс выглядит так:
- Пластины выставляются в крепежные элементы в строго определенном порядке, по очереди.
- Для закрепление каждой пластины ее необходимо «подпружинивать».
- После расположения всех элементов, механизм закрывается верхней крышкой замка.
После сборки любого замка необходимо обязательно проверить его работу без монтажа в дверь. В некоторых случаях может потребоваться дополнительная разборка и сборка. Перед началом работ желательно найти в интернете схему замка или его бумажную инструкцию. Если во время работы обнаружился неисправный или поврежденный элемент, то его необходимо обязательно заменить
ООО «БАРС-Х». Сервис. Ремонт дверей, замена замков
Фирма ООО «Барс-Х» — лицензированная, сертифицированная сервисная служба!
Вас приветствует фирма, компания ООО «Барс-Х» созданная в 1996 году для оказания помощи населению! Официально зарегистрированная в 1998 году! Последняя дата перерегистрации 14 августа 2009 г. ОГРН 1097746448304. Ремонтное подразделение быстрого реагирования: Замена замков, установка, врезка и ремонт, доставка механизмов замков. Сервис по замкам и дверям осуществляется ежедневно и без выходных с выездом мастера с замками на выбор в кратчайшее время. Любую услугу выполним Быстро — Качественно — Надежно! С нами Ваша безопасность в надежных руках!
ОГРН 1097746448304. Ремонтное подразделение быстрого реагирования: Замена замков, установка, врезка и ремонт, доставка механизмов замков. Сервис по замкам и дверям осуществляется ежедневно и без выходных с выездом мастера с замками на выбор в кратчайшее время. Любую услугу выполним Быстро — Качественно — Надежно! С нами Ваша безопасность в надежных руках!
(Лицензия МЧС России выданная Главным управлением министерства российской федерации по делам гражданской обороны, чрезвычайным ситуациям и ликвидации последствий стихийных бедствий по городу Москве – №38-2/00961 на выполнение работ по монтажу, ремонту и обслуживанию зданий, изделий и конструкций, не только дверных блоков, но и сигнализаций….) БАРС-Х – это крупная организация по оказанию услуг в сфере быта по ремонту дверей, замене, установке замков, надежных замков, систем контроля доступа в помещение, видеонаблюдения, защите замков, полного или частичного «апгрейда» металлической – стальной двери и замков. Имеем многолетней опыт в оказании услуг. Мы знаем, что Вам предложить!
Мы имеем прямые контакты практически со всеми поставщиками замков и отделочных материалов двери! А это значит что мы в курсе всех новинок, знаем их слабые и сильные стороны замков. Мы работаем только с сертифицированной проверенной продукцией, «оригинальными» механизмами (замками) как отечественного, так и импортного производства.
С нами Вы можете быть спокойны за оригинальность продукции! У нас есть практически все замки и модели как импортного EVVA, Mottura, Cisa, Atra-Dierre, Kaba, Kaba-Mauer, Abus, DOM, Abloy, Mul-t-lock, Super-Lock, Gerda, Securemme и многих других лидирующих производителей, так и отечественных фирм, для входных дверей металлических, железных, стальных, бронированных. Мы знаем ассортимент замков в магазинах и на рынках Москвы огромен. Мы поможем разобраться. Аргументировано предложим варианты. Квалифицированно осмотрим конструкцию двери и грамотно подберем оптимальную комплектацию замков, отвечающую Вашим требованиям безопасности.
Мы знаем ассортимент замков в магазинах и на рынках Москвы огромен. Мы поможем разобраться. Аргументировано предложим варианты. Квалифицированно осмотрим конструкцию двери и грамотно подберем оптимальную комплектацию замков, отвечающую Вашим требованиям безопасности.
У нас самый большой выбор декоративных панелей для эстетического вида, Вашей двери! Только у нас специалисты широкого профиля знающие и любящие свою работу!
Мы предложим весь ассортимент отделки двери: винил кожа, шпон, ламинат, пластик, постформинг, массив, корабельная фанера (авиационная фанера)… Варианты цветовой гаммы и рисунков удивят даже изысканного заказчика! У нас есть все!
Мы предоставим полную документацию на заменяемые замки! Вся наша продукция сертифицирована.
Мы гарантируем разумные цены на работы и устанавливаемые механизмы разрешенные правом торговли законами РФ! Работы производятся по наличному и безналичному расчету, за нал или безнал — решать вам!
Мы гарантируем качественную работу, если это не правда – Мы вернем Вам деньги! Обладая знаниями, всей необходимой документацией и оригинальными комплектующими мы квалифицированно выполним поставленную перед нами задачу.
Мы можем гарантировать честность и порядочность! Мы в курсе новинок поставляющих в Россию! И Мы не побоимся сказать Мы профессионалы!
Мы уверены! Вы, останетесь довольны! С помощью наших мастеров — специалистов ваш дом или офис станет неприступной крепостью. У нас работают только москвичи, высококвалифицированные мастера, дипломированный руководящий состав, отлично знающие свое дело, которые быстро, легко, без потери времени и качества могут выполнить любые работы, связанные с замками и дверьми, а также оказать услуги по консультации практически в любых вопросах, касающихся врезке замены замка, ремонта двери. Ассортимент предлагаемых нами услуг постоянно расширяется, чтобы удовлетворить требования самых изысканных заказчиков, знающих толк в замках, надежных замках, взломостойких замках, кто действительно хочет защитить свой дом от взлома, кражи.
Ассортимент предлагаемых нами услуг постоянно расширяется, чтобы удовлетворить требования самых изысканных заказчиков, знающих толк в замках, надежных замках, взломостойких замках, кто действительно хочет защитить свой дом от взлома, кражи.
Главный принцип работы компании Барс-Х: максимально качественный сервис и индивидуальный подход к каждому клиенту! Мы с радостью можем предложить все услуги и конечно же подберем для Вас как механические замки, так и системы контроля доступа в помещение (скрытые — замки, видеонаблюдение, биометрические замки, электронные замки…). В нашу пользу говорит «время», опыт работы, довольные клиенты. Мы сделаем все возможное, чтобы у вас остались только приятные впечатления! А Ваши замки стали по настоящему надежными, работоспособными и эстетичными!
Доверьте профессионалам установку и подбор замков (механических, электронных ) на входную дверь, квартирную, офисную – это инвестиция в безопасность, и спокойствие семьи, спокойствие за своих близких и родных. А еще сэкономить и получить скидку! Разве это не приятно?
МЫ ВСЕГДА С ВАМИ, МЫ РЯДОМ! ЗАМОК, ДВЕРЬ ТРЕВОЖИТ БАРС-Х ПОМОЖЕТ!
ФОТО НЕКОТОРЫХ НАШИХ РАБОТ:Замок зажигания, личинка. (Р) (с. 16)
В силу обстоятельств пришлось погрузиться в тему — собрать личинку для замков FF1.Личинка имеет 6 сувальд, соответственно на ключе шесть зон — (от ручки) ABCDEF, каждая позиция может принимать значение от 1 до 4.
Определить значение (формулу ключа) можно по новому ключу, по маркировке сувальд из какой-либо личинки, сличением старых сувальд и новых. В каждой зоне ключа есть 4 симметричных поверхности, каждая зона характеризуется разным углом фрезеровки:
1 — плоская без фрезеровки, 2 — мелкий пропил, 3 — глубокий неполный пропил, 4 — пропил на всю четверть заготовки (сувальда без маркировки). На рисунке показано схематическое сечение ключа.
.
По пропилам определяется формула ключа, например, A1B2C4D2E4F3.
 Этого достаточно, чтобы собрать ячейку из комплекта 1022461 (замок зажигания) или дверей, капота, лючка, багажника… или изготовить дубликат ключа. Старый ключ не нужен…
Этого достаточно, чтобы собрать ячейку из комплекта 1022461 (замок зажигания) или дверей, капота, лючка, багажника… или изготовить дубликат ключа. Старый ключ не нужен… На фото набор для замка зажигания, состоящий из:
2 — сувальды 3*4 = 12 шт.,
3a — симметричные шайбы 4 шт.,
3b — несимметричная шайба 1 шт.,
4 — штифт 1 шт.
5 — «носик с закрывалкой» 1+1 шт., как называются не знаю…
6 — внутреннее запорное кольцо 1 шт.,
7 — внешнее запорное кольцо-фиксатор 1 шт. (он не дает личинке выниматься, кроме поз. ключа 1)
8 — внутренний стакан (корпус) 1 шт.,
9 — внешний стакан 1 шт.
Схема и очередность сборки показана на схеме.
Если вставить ключ в правильно собранную личинку, то сувальды выстроятся таким образом, что в прорези внутреннего стакана образуется впадина, куда проваливается штифт, и замок может вращаться. Можно проверять после вставки каждой очередной сувальды.
Собранный внутренний стакан завальцовывается молотком. Корпус силуминовый, сильно стучать не стоит. Желательно чуть-чуть закрепить и проверить личинку, только потом закреплять окончательно, хрупкий материал!
Закрепляется сборка внутренним запорным кольцом (6), которое должно попасть в канавку.
Последним устанавливается вешний фиксатор (7), см. фото.
Использовал фото коллег Vyacheslav161 и sarfom, надеюсь на согласие.
Всем удачи.
Ремонт личинки замка зажигания в AutoKey
Однажды, сев за руль вы заметили, что сложно вставляется ключ в замок зажигания или, наоборот, сложно извлекается, с трудом поворачивается ключ. Есть вероятность, что проблема заключается в контактной группе или сломалась личинка замка зажигания (может пришла в негодность из-за длительного использования). Личинка играет главную роль в работе замка.
Причину легко узнать, если разобрать полностью замок.
Перечисленные выше неполадки могут происходить по нескольким причинам:
- Ключ сломался в самом замке, извлечение невозможно.

- Повреждение, нанесённое самим водителем, из-за резких движений и «расшатывания» ключом в замке (или разрушения исходя из попытки взлома).
- Штифты или ключи сломались, в связи с износом.
- Подгорели контакты.
- Накопилась грязь, пыль и т. д.
Здесь либо чинить, либо менять полностью личинку.
Не стоит спешить смазывать замок маслом, бензином, WD и т. д. Это может усугубить положение.
Произвести ремонт личинки замка зажигания можно самостоятельно.
Прежде чем осуществить разбор и отремонтировать замок зажигания необходимы такие инструменты как:
- Пассатижи.
- Молоток (желательно небольшой).
- Отвёртка крестовая.
- Отвёртка плоская тонкая.
- Тонкое сверло.
- Возможно, потребуется ремкомплект личинки с ключами.
Устройство замка общее для всех автомобилей, а вот способы разборки индивидуальны.
Подготовка к ремонту
Для начала отсоединить аккумулятор, тем самым обесточив машину.
У некоторых машин есть возможность поменять личинку — не снимая, но в большинстве своём приходится снимать полностью замок с рулевой колонки. В случае если конструкция позволяет — можно обойтись без снятия и разборки, но всё подкреплено сбоку с помощью штифта. Чтобы вынуть штифт следует воспользоваться тонкой отвёрткой, если не достаётся, то применить тонкое сверло. Когда вы это всё проделали, достав штифт, то заметили, как личинка слегка вышла из корпуса. Далее, как её добыть ради замены будет ясно, новая деталь будет ставиться в обратном порядке.
Если ремонт невозможен без снятия, то нужно убрать болты, которые крепятся к рулевой колонке. Это специальные болты со срезанными головками и без каких-либо шлицев. Но для начала отсоедините колодку с проводами от замка зажигания, таким образом снимается узел с автомобиля. Затем при помощи зубила и молотка отворачиваем болты. Снимаем кожух замка зажигания, весть этот «пластик» рулевой колонки. Получили доступ к замку зажигания и его личинке, ну и колодке с проводами.
Получили доступ к замку зажигания и его личинке, ну и колодке с проводами.
Выкручиваем три винта снизу кожуха замка зажигания. Снять нижнюю половинку пластиковой крышки и освободить два фиксатора настройки, вынув, таким образом, контакты с проводами. Снимаем верхнюю половинку кожуха, она на защёлках, поэтому снимается легко и затем, слегка потянув пальцами, снимается с кожуха иммобилайзера.
При откручивании болтов, с помощью которых личинка крепится к корпусу замка, стоит держать его в вертикальном положении, замочной скважиной вверх. Иначе мелкие детали замка могут выпасть и потеряться, в дальнейшем будет сложнее осуществлять восстановление замка зажигания.
Вытащили личинку вместе с ключом, провернуть ключ в замке, вынуть сердцевину с секретами. Заметили, что вставив ключ не все пины в корпусе сердцевины «спрятались», скажем так правильно «заподлицо» они должны быть. Вынимаем пины, записывая себе, где какой находится, пружинки складываем отдельно. Потом пружинки пальцами слегка растягиваем, чтобы придать первоначальный вид и восстановить форму.
Если пины не сточились, то можно их просто помыть, промойте и отверстия под пины. Достаточно тряпки или лоскуток ткани, смоченной в спирте/бензине/растворителе. В случае если пины в ужасном состоянии, то тут понадобится ремкомплект, заменяем пины на новые (всё равно промыть отверстия под пины).
Вставляем пины и пружинки на свои места. Теперь проверяем: вставляем ключ, поворачиваем, если все пины лежат ровно «заподлицо», то работа выполнена. Собрали личинку, убедившись, что всё хорошо работает – смазываем пины.
Как собрать дверной замок: схема и видеоинструкция
Если замок называют надежным, будьте готовы к тому, что его конструкция будет достаточно сложной, вместе с тем есть ряд исключений из правил. Одно можно утверждать точно, если возникла необходимость собрать или разобрать замок, потребуется схема устройства.
Читайте также: Как можно открыть дверной замок без ключа
Подготовка к сборке
Как правило, чтобы отремонтировать дверной накладной или врезной замок, его нужно для начала разобрать. Прежде чем устанавливать новое устройство на дверь, его разбирают с целью исключения брака или для удаления иногороднего тела (если таковое имеется). Для того чтобы починить замок, его обязательно придется разобрать.
Прежде чем устанавливать новое устройство на дверь, его разбирают с целью исключения брака или для удаления иногороднего тела (если таковое имеется). Для того чтобы починить замок, его обязательно придется разобрать.
Часто встречается, что ремонтники-аматоры с целью ремонта разбирают устройство, а после этого собрать его воедино не могут. Со стороны это выглядит довольно смешно и нелепо, однако специалисты утверждают, что происходит такое достаточно часто.
Читайте также: Как правильно снять дверную ручку межкомнатной двери
В такой нелепой ситуации можно оказаться даже когда, замок не снимается с двери, а разбирается частично для чистки или смазки. Достаточно, чтобы одна пружина была упущена, и устройство не будет корректно функционировать. Для того чтобы избежать подобной ситуации, не нужно спешить вскрывать корпус устройства. Для начала необходимо достать схему устройства и внимательно ее изучить. Как правило, схема идет в комплекте с замком, если она утеряна, ее можно посмотреть в интернете. Схема позволит изучить:
- Комплектацию составляющих деталей и их расположение.
- Принцип крепления элементов.
- Функционал каждого составляющего.
Схема – это не единственное, что может потребоваться. Запирающее устройство не разберешь голыми руками, поэтому придется подготовить специальный инструмент:
- отвертка;
- ключ оригинал, открывающий секретный механизм;
- пинцет, шило;
- смазка для замков.
Порядок сборки и разборки устройств
Разобрать сам замок, в принципе, не составляет особого труда, если не касаться самого секретного устройства. Мелкие составляющие детали выходят из строя довольно часто по разным причинам, но заменить их не составляет особого труда. Большинство цилиндровых замков имеют три основных элемента:
- Корпус.
- Ригель.
- Личинка.
Главной в этом составе можно назвать личинку, так как без нее первые два элемента ничто. Именно личинка и есть тем секретным элементом, который управляет ригелями. Для замены личинки нужно открыть дверь и внимательно изучить торец полотна двери в районе выходных отверстий под ригели. Именно в том месте располагается крепежная составляющая, которая удерживает цилиндр в корпусе.
Именно личинка и есть тем секретным элементом, который управляет ригелями. Для замены личинки нужно открыть дверь и внимательно изучить торец полотна двери в районе выходных отверстий под ригели. Именно в том месте располагается крепежная составляющая, которая удерживает цилиндр в корпусе.
Как только крепежная часть изъята, ключ нужно вставить в замочную скважину и достать личинку. После того как замена выполнена, сборку проводят так же, только в обратной последовательности.
Работа будет сложнее, если нужно разбирать саму личинку. Это делается обычно для перекодирования или для изготовления по ней ключа. Нельзя утверждать, что это невозможно сделать, просто для этого потребуется специальный инструмент, без которого за эту работу лучше не браться. Если подобного опыта у вас еще нет, тогда лучше придерживаться следующей схемы:
- Нужно извлечь из корпуса цилиндр.
- Достаем стопорное кольцо.
- Вставляем ключ в скважину и проворачиваем его на 180 градусов.
- При помощи двух спиц фиксируем пины, которые находятся внизу секрета.
- После этого можно достать верхние пины и выполнять все необходимые действия.
Нюансы в сборке запирающих устройств
Многие считают, что собрать замок после ремонта довольно просто и недооценивают сложность данной работы. На самом деле все намного сложнее, чем может показаться на первый взгляд. Придерживаясь следующих советов, можно избежать всех нюансов, которые могут возникнуть в процессе этой работы:
- После того как вы самостоятельно собрали замок, не забудьте проверить его на работоспособность при помощи ключа.
- Расположение внутренних элементов должно совпадать со схемой.
- Не стоит перетягивать крепежи, это может негативно отразиться на работе всего устройства.
- Если обнаружены нерабочие элементы, их нужно заменить. Если такая возможность отсутствует, меняйте все запирающее устройство.
На межкомнатной двери запирающие устройства, как правило, не ставят. На ней используют обычную ручку для фиксации.
На ней используют обычную ручку для фиксации.
Личинка | Castlevania Wiki | Фэндом
Личинка
Работа Личинки из гайда All About Akumaj Dracula.Японское название
ラ ル ヴ ァ Рарува
Геге
Альтернативное имя
Скелет личинки
Способности
- Левитация
- Скользит, пытаясь нанести контактный урон
Описание
Летучий дух с телом червя, а иногда и с головой человека. Они летают и покачиваются по экрану ленивыми, бесцельными движениями и часто постоянно появляются за пределами экрана.
Матчи
Супер Кастлевания IVКрасный червь появляется в Неживых Кварталах Super Castlevania IV . Он беспорядочно перемещается по комнате и, кажется, парит в воздухе или ползет по стенам, так как он также обвивает своим телом колонны на заднем плане.В большинстве случаев он остается над верхней половиной экрана, что затрудняет попадание в него, и в конечном итоге выйдет из комнаты, если его не убить вовремя. Успешная победа над ним принесет столько же очков, чем за убийство Костяного Дракона.
|
Соответственно названные скелетами личинок в Rondo of Blood , эти враги теперь имеют форму человеческого черепа и позвоночника, что придает им вид летающего червя. Они заметно короче своих аналогов Super Castlevania IV и появляются в бесконечном количестве за пределами экрана, а затем возвращаются домой к герою.
Они заметно короче своих аналогов Super Castlevania IV и появляются в бесконечном количестве за пределами экрана, а затем возвращаются домой к герою.
Обычно они появляются в областях, где требуется продвинутая платформа, например, в комнатах с несколькими лестницами или с движущимися платформами.
|
В Dawn of Sorrow Личинка описывается как жестокий дух, обитающий в гигантском черве, и на этот раз он действительно может похвастаться головой существа, похожего на многоножку.Их поведение больше похоже на поведение их аналога Super Castlevania IV : сначала они беспорядочно скользят высоко над комнатой, а затем либо беспорядочно возвращаются к Соме, либо просто покидают экран.
|
Личинки в Portrait of Ruin имеют немного другое поведение, хотя и имеют некоторое сходство со своими аналогами Rondo of Blood . Они бесконечно появляются из-за пределов экрана и летают в общем прямом направлении, стремительно зигзагообразно скользя своим телом.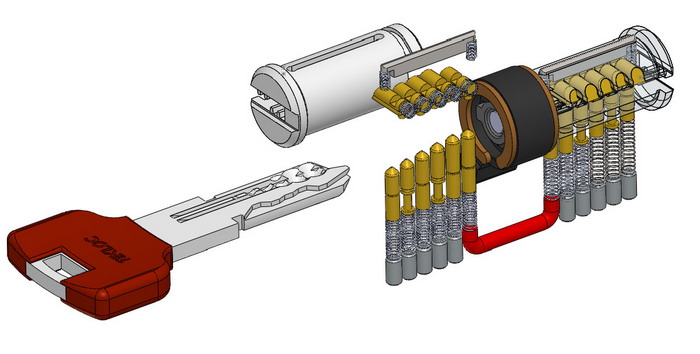 На этот раз они могут похвастаться головой бородатого мужчины, прикрепленной к телу червя.
На этот раз они могут похвастаться головой бородатого мужчины, прикрепленной к телу червя.
|
Данные души
Галерея
Произведения
См. Также
Список литературы
5 методов, которые помогут вам поднять собственных королев
Хотели бы вы иметь возможность поднять собственных дам?
Идея выращивания собственной матки не приходит в голову начинающему пчеловоду.Но по мере того, как ваш опыт будет расти, скоро станет очевидно, что это дает много преимуществ. Вы сможете строить свои собственные ульи, продавать маток в качестве побочного бизнеса и при необходимости обновлять собственные ульи.
Так как именно вы это делаете? Давайте обсудим!
На самом деле существует несколько различных способов поднять ферзей. Мне известно о 5 из них, поэтому я хотел поделиться с вами каждым из них. Затем вы можете выбрать, какой метод вам больше нравится, и надеяться на большой успех в выращивании собственных ферзей в будущем.Давайте начнем.
Прививка
Прививка — это один из вариантов выращивания собственных маток. Во-первых, вы ждете, пока вылупятся личинки. Затем вы воспользуетесь прививочным инструментом, чтобы вычерпать только что вылупившихся личинок.
Важная часть этого шага — убедиться, что вы не переворачиваете личинок. На самом деле он может утонуть в собственной жидкости. Если случайно вы это сделаете, просто переходите к следующим личинкам.
Затем вам нужно поместить личинок в стартер клеток или улей без матки. Пчелы вытянут за вас маточники. Потом их закроют. После того, как маточники будут закрыты, вы поместите привитые клетки в действительно сильный улей. Пчелы в этом улье будут держать клетки в тепле.
Пчелы вытянут за вас маточники. Потом их закроют. После того, как маточники будут закрыты, вы поместите привитые клетки в действительно сильный улей. Пчелы в этом улье будут держать клетки в тепле.
Теперь, в течение всего этого процесса вы отсчитываете 16 дней от яйца до вылупившейся матки. Так вы будете точно знать, когда вылупится королева. Это важно, чтобы ее не убили пчелы, которые когда-то согревали ее.
Итак, когда вы дойдете до 16 дня, вам нужно будет поставить над ней клетку королевы, чтобы обезопасить ее до тех пор, пока вы не будете готовы переместить ее в ядерный или брачный бокс.Но если вы решите продать ее как девственную королеву, вы просто оставите ее в покое, пока она не будет продана. И это, друзья мои, все, что нужно для прививки.
Пробойник для клеток
Cell punch — любимый способ моего мужа поднять ферзей. На самом деле мы выращиваем собственных маток, но, честно говоря, это, вероятно, его любимая часть разведения пчел.
Итак, когда я сказал ему, что собираюсь написать статью на эту самую тему, он очень хотел поделиться всей информацией, которую он собрал во время обучения выращиванию ферзей.Излишне говорить, что когда мы добрались до ячейки, он был очень взволнован! Но я отвлекся …
Если вы решите использовать метод перфорации при выращивании маток, вы должны использовать рамы без фундамента или восковые рамы. Причина в том, что вы собираетесь пробить отверстие в рамке для расплода. Поэтому пластик для этого метода просто не подойдет.
При использовании этого метода вам придется изготовить инструмент, называемый перфорацией ячеек. Вот как его сделать. Насколько мне известно, пока они нигде не продаются.
После создания инструмента для перфорации ячеек вы найдете нужную ячейку. В нем должны быть очень молодые личинки. Поместите кольцо перфоратора прямо над личинками и вытолкните его.
Этот вид напоминает мне бумагу и ручной дырокол. Если вы никогда не видели этого раньше, надеюсь, это даст вам достойный вид.
Тогда вытащите вилку. А затем вы завершите процесс так же, как и с прививкой.
Замечательная особенность этого метода (и почему мой муж так его любит) состоит в том, что пчелы с большей вероятностью будут производить маток с помощью этого метода, потому что он пахнет естественным для них.
Итак, исходя из нашего опыта, вы с большей вероятностью добьетесь успеха в рейзе ферзей с помощью этого процесса.
Перенаселенность
Это еще один простой вариант. По сути, вы позволите ядерному оружию быть переполненным.
Однако перед тем, как это сделать, обязательно поместите исключающий ферзя на вход ядерной бомбы.Как вы, наверное, знаете, когда пчелы начинают собираться, они готовятся к рою. Это означает, что пчелы начинают производить маточники, поэтому половина улья уйдет с ней.
Тогда у вас будут естественные маточники, из которых можно вырезать пробки и поместить в улей без матки. Пчелы позаботятся о ней и, надеюсь, примут ее, когда она вылупится, чтобы у них родилась матка.
Замок Королевы
Этот метод требует покупки замка королевы. У некоторых из наших друзей был такой, и они позволили нам его использовать.Излишне говорить, что мой муж тоже полюбил этот метод, потому что он может вырастить столько ферзей одновременно.
Итак, этот специальный корпус улья имеет четыре входа и четыре герметичных отсека. Вы фактически делаете четыре миниатюрных шпагата.
Теперь каждая секция обычно содержит две рамки. Будет одна рамка с выводком, молодыми личинками и яйцами. В другом кадре должно быть много пыльцы и меда.
Затем вы добавите столько пчел, сколько сможете встряхнуть, в замок королевы.Затем пчелы найдут жизнеспособные яйца, из которых они смогут сделать маток.
В среднем на рамке расплода может быть от одной до десяти маточников. Итак, после того, как маточники разовьются, вы должны их вырезать или оставить в покое, и автоматически произойдет разделение. Наш опыт знакомства с замком королевы был приятным.
Сплит
Не так давно я написал здесь на PerfectBee статью о том, как выполнять сплит. Вы можете прочитать его здесь .
Но у вас есть много причин для выполнения сплита.Это может увеличить ваши цифры, что увеличит вашу продуктивность и производство меда.
Еще одна веская причина для выполнения сплита — не дать пчелам роиться. Однако, когда вы выполняете сплит, вы можете побудить своих пчел вырастить в процессе еще одну матку.
Все, что вам нужно сделать, это поместить рамки с расплодом в щель, на которых есть маточники. Пчелы — очень умные существа. Они знают, что им нужна дама, и обычно поднимают ее.
Как только она родится и будет принята в улей, у вас будет новый и процветающий улей.
Сводка
Итак, как вы понимаете, есть много вариантов рейза дам. Мой муж является «воспитателем королевы» между нами двумя, но я внимательно наблюдала, как он пробовал использовать все эти методы.
Они будут работать, но одни оказываются проще других. Вам просто нужно решить, какой метод лучше всего подходит для вас.
Теперь, когда я рассмотрел все методы, которые мы пробовали поднимать ферзей, есть ли у вас другой метод? Какой у вас был опыт выращивания собственных ферзей?
Если вы никогда раньше не поднимали ферзей, что вас сдерживает? У вас есть определенные вопросы, ответы на которые помогут вам преодолеть этот горб и вы сможете заняться выращиванием собственных королев?
Что ж, мы будем рады услышать от вас.Пожалуйста, оставьте свои комментарии в отведенном для этого месте ниже.
Протеом гемолимфы сытых и голодных личинок дрозофилы
Образец цитирования: Handke B, Poernbacher I, Goetze S, Ahrens CH, Omasits U, Marty F, et al. (2013) Протеом гемолимфы сытых и голодных личинок дрозофилы. PLoS ONE 8 (6): e67208. https://doi.org/10.1371/journal.pone.0067208
Редактор: Энди Т. Ю. Лау, Медицинский колледж Университета Шаньтоу, Китай
Ю. Лау, Медицинский колледж Университета Шаньтоу, Китай
Поступила: 13 марта 2013 г .; Дата принятия: 17 мая 2013 г .; Опубликован: 20 июня 2013 г.
Авторские права: © 2013 Handke et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана грантами от SystemsX.ch WingX), приоритетной программы университетских исследований «Системная биология / функциональная геномика» Цюрихского университета и Швейцарского национального научного фонда. CHA и EB являются членами Инициативы по количественной модельной протеомике организмов, которая частично финансируется Университетской программой приоритетных исследований системной биологии / функциональной геномики Цюрихского университета.Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что конкурирующих интересов не существует.
Введение
Внеклеточные жидкости организма, например плазма крови или интерстициальная жидкость, служат транспортными системами для метаболитов, питательных веществ, гормонов или кислорода практически у всех животных. У насекомых есть только одна внеклеточная жидкость, называемая гемолимфой, которая обычно поддерживается открытым сердцем в полости тела.Гемолимфа находится в непосредственном контакте со всеми внутренними органами. Он доставляет в клетки необходимые вещества, такие как питательные вещества, и транспортирует продукты метаболизма от этих же клеток. Он содержит гемоциты, большинство из которых являются фагоцитарными клетками [1]. Более того, он содержит белки, которые обеспечивают гемостатический ответ на рану [2]. Многие дополнительные белки гемолимфы помогают защитить насекомое от вторжения микроорганизмов [3]. Гормоны, которые регулируют время развития, метаморфоз, метаболизм, рост, размножение и связанное с ним поведение, секретируются и циркулируют в гемолимфе [4], [5], [6], [7], [8].
Многие дополнительные белки гемолимфы помогают защитить насекомое от вторжения микроорганизмов [3]. Гормоны, которые регулируют время развития, метаморфоз, метаболизм, рост, размножение и связанное с ним поведение, секретируются и циркулируют в гемолимфе [4], [5], [6], [7], [8].
Несмотря на важность для развития и физиологии, информация о составе гемолимфы насекомых ограничена. Первоначальные биохимические анализы были сосредоточены на низкомолекулярных соединениях, таких как неорганические соли, аминокислоты, органические кислоты, липиды и сахара [9], но мало что известно о белковом составе гемолимфы. Протеомика (МС), основанная на масс-спектрометрии, стала мощным инструментом для мониторинга состава белков в жидкостях организма в различных состояниях. Исследования на нескольких видах насекомых идентифицировали белки гемолимфы после разделения с помощью одно- и двумерного гель-электрофореза в сочетании с МС [10], [11], [12], [13], [14], [15], [16] ], [17], [18], [19], [20], [21], [22], [23].Более полный протеомный анализ, включающий расщепление белков гемолимфы в растворе с последующей жидкостной хроматографией-масс-спектрометрией (ЖХ-МС), был проведен для медоносной пчелы [24], но он явно отсутствует для плодовой мухи Drosophila melanogaster , насекомого Модельная система, наиболее широко используемая в клеточной биологии и биологии развития, дала неоценимую информацию, имеющую очень важное значение для эукариот, включая человека.
Элегантные эксперименты по совместному культивированию с изолированными органами от личинок дрозофилы убедительно свидетельствуют о том, что голодание влияет не только на метаболиты [25], [26], [27], но также на состав сигнальных факторов гемолимфы [28] и недавние генетические исследования. анализы четко идентифицировали секретируемые сигнальные белки, которые, как полагают, имеют переменную концентрацию гемолимфы, регулируемую статусом питания [29], [30], [31].Следовательно, сравнение образцов гемолимфы от накормленных и голодных личинок может в принципе также указать на новые кандидаты сигнальных факторов, хотя их часто очень низкие эффективные концентрации представляют собой серьезную проблему.
Здесь мы представляем глубокий протеомный анализ образцов гемолимфы от личинок Drosophila третьего возраста. Общая цель этого исследования состояла в том, чтобы создать полную протеомную карту [32] личиночной гемолимфы Drosophila . Кроме того, мы описываем первый шаг к пониманию влияния условий питания на белковый состав гемолимфы.Наши результаты увеличивают количество известных белков гемолимфы почти на порядок и демонстрируют драматическое воздействие голодания на запасные белки.
Материалы и методы
Drosophila Культура и выделение гемолимфы Мух из штамма Oregon R ( OreR ) дикого типа культивировали при 25 ° C и относительной влажности 45% на стандартном корме (100 г / л дрожжей, 75 г / л сахарозы, 55 г / л кукурузной муки, 10 г / л пшеничной муки, 8 г / л агара, 0.45 мл / л нипагина, 0,9 мл / л пропилпарабена). Для получения личинок для сбора гемолимфы первоначальный сбор яиц для удаления перезрелых яиц выполняли в течение 1 часа в бутылях со свежими мухами со стандартным кормом. После этого мух переносили в другой набор бутылочек со свежими мухами со стандартным кормом и собирали яйца в течение 2 часов. Мух отбрасывали, а бутылки с яйцами инкубировали при 25 ° C. После инкубации в течение 64 часов личинок вымывали из корма и переносили либо в бутылки со свежим стандартным кормом (скармливали), либо в бутылки с фильтровальной бумагой, пропитанной 20% сахарозой (голодание).Выделение гемолимфы начинали после инкубации еще в течение 24 часов при 25 ° C. Непосредственно перед сбором гемолимфы поверхность личинок стерилизовали в 70% этаноле. Избыточную жидкость удалили фильтровальной бумагой. Партии из 10-15 личинок погружали в галоидуглеродное масло высокой вязкости (Halocarbon-oil 1000N, Solvadis Chemag, # 102780) и открывали, осторожно раздвигая эпидермис щипцами, чтобы вызвать кровотечение гемолимфы. Гемолимфа, скопившаяся в капле вокруг личинок, была собрана тонкой стеклянной пипеткой, перенесена в пробирку Эппендорфа и немедленно заморожена в жидком азоте. Мы подчеркиваем, что наша процедура выделения не включала удаление гемоцитов, чтобы минимизировать время, доступное для возможных протеолитических и химических модификаций белков гемолимфы во время изоляции, которые могут повредить последующим протеомным анализам. Полная процедура отбора проб до замораживания заняла менее двух минут и привела к 3–4 мкл гемолимфы на аликвоту. От 30 до 40 аликвот, собранных из трех независимых партий личинок, были объединены для анализа MS, в результате которого были получены данные, описанные в таблице S1.Пулы примерно из 20 дополнительных аликвот, собранных из независимых партий личинок, были использованы в первоначальном пилотном анализе MS. Стадии развития личинок определяли на основании морфологии ротового крючка [33].
Мы подчеркиваем, что наша процедура выделения не включала удаление гемоцитов, чтобы минимизировать время, доступное для возможных протеолитических и химических модификаций белков гемолимфы во время изоляции, которые могут повредить последующим протеомным анализам. Полная процедура отбора проб до замораживания заняла менее двух минут и привела к 3–4 мкл гемолимфы на аликвоту. От 30 до 40 аликвот, собранных из трех независимых партий личинок, были объединены для анализа MS, в результате которого были получены данные, описанные в таблице S1.Пулы примерно из 20 дополнительных аликвот, собранных из независимых партий личинок, были использованы в первоначальном пилотном анализе MS. Стадии развития личинок определяли на основании морфологии ротового крючка [33].
Подготовка проб для масс-спектрометрии
Объединенные аликвоты гемолимфы ненадолго центрифугировали для удаления нерастворимого материала и лизировали в 50 мМ (NH 4 ) HCO 3 , содержащем 0,2% RapiGest (Waters). Концентрацию белка определяли на флуорометре Qubit (Invitrogen).1 мг лизата общего белка восстанавливали 5 мМ трис (2-карбоксиэтил) фосфин гидрохлоридом (TCEP) и обрабатывали 10 мМ йодацетамидом для модификации остатков цистеина. Триптическое расщепление проводили в течение ночи, используя 20 мкг трипсина (Promega) на образец и концентрацию RapiGest 0,1%. Образцы очищали обращенно-фазовой хроматографией C-18 (Sep-PaK, Waters). Для фракционирования образцов проводили изоэлектрическое фокусирование пептидов (фракционер OFFGEL 3100, Agilent). Использовали 24-луночный стрип с линейным градиентом pH от 3 до 10 (GE Healthcare).Фракционирование геля (OG) проводили, как описано [34]. Короче говоря, фракционирование OG начинали после внесения 150 мкл раствора пептида в каждую лунку. Потенциал был зафиксирован в течение первого часа на уровне 500 В, затем был установлен на максимум 8000 В и после завершения разделения поддерживали на уровне 500 В (всего 50 кВ · ч; общее время работы ~ 18 часов). Предел тока был установлен на уровне 100 мкА, а температура поддерживалась на уровне 20 ° C. После фракционирования OG 24 пептидные фракции очищали обращенно-фазовой хроматографией C-18 (MicrospinColumns, SEM SS18V, The Nest Group, Inc).
Предел тока был установлен на уровне 100 мкА, а температура поддерживалась на уровне 20 ° C. После фракционирования OG 24 пептидные фракции очищали обращенно-фазовой хроматографией C-18 (MicrospinColumns, SEM SS18V, The Nest Group, Inc).
Масс-спектрометрический анализ
Для масс-спектрометрического анализа образцы ресуспендировали в 50 мкл буфера A (5% ацетонитрил, 0,2% муравьиная кислота). Из каждого образца 1 мкл материала загружали в LTQ-Orbitrap XL ETD (Thermo Fisher Scientific). Прибор был подключен к системе Eksigent nano-LC. Образцы автоматически вводили в петлю для образцов объемом 10 мкл и загружали в аналитическую колонку, которая была заполнена на заводе шариками Magic C18 AQ (3 мкм, 100 Å, Microm) длиной 9 см × 75 мкм (внутренний диаметр).Смеси пептидов подавали в аналитическую колонку со скоростью потока 500 нл / мин (3% ацетонитрил, 0,2% муравьиная кислота) в течение 16 минут, а затем элюировали с использованием градиента ацетонитрила (3–35%; 0,53% / мин). с 0,2% муравьиной кислоты с расходом 250 нл / мин. Выборки были измерены в обзорном сканировании от 300 до 2000 AMU, с последующим 6 зависящими от данных сканированиями MS / MS с динамическим исключением (ширина изоляции 2 AMU, количество повторений 1, размер списка исключения 500, длительность динамического исключения 60 с).При втором сканировании были применены те же настройки с добавлением статического списка исключений всех пептидов, отслеживаемых при первом сканировании. Список статических исключений содержал все спектры MS1 с назначенными MS / MS из первого прогона съемки. Впоследствии первые два сканирования обзора были использованы для создания третьего сканирования обзора со списками включения для функций MS1, которые не были проанализированы ни первым, ни вторым запуском MS. Списки включений для всех фракций OG были созданы с помощью программного инструмента Progenesis (Non Linear Dynamics, New Castle Upon Tyne, UK Version 4.0). Вручную устанавливали векторы засева (4–7) на все время удерживания с последующим автоматическим выравниванием карт признаков с порогом чувствительности 3. Для их удаления применялись фильтры для признаков с МС / МС. Остальные функции MS1 были экспортированы с окном времени удерживания 2,5 мин в список включения, совместимый с Xcalibur. Сгенерированный список включений был использован для выполнения третьего обзорного сканирования соответствующей фракции OG. Всего было выполнено 144 измерения.
Для их удаления применялись фильтры для признаков с МС / МС. Остальные функции MS1 были экспортированы с окном времени удерживания 2,5 мин в список включения, совместимый с Xcalibur. Сгенерированный список включений был использован для выполнения третьего обзорного сканирования соответствующей фракции OG. Всего было выполнено 144 измерения.
Поиск в базе данных и идентификация белков
Необработанные данные были преобразованы в открытый формат mzXML.Используя алгоритм Sequest [35], масс-спектры фрагментов были исследованы в базе данных последовательностей белков, содержащей 21 317 белков D. melanogaster (FlyBase версии 2008_10) и 256 обычных загрязнителей (кератины, трипсин и т. Д.). Спектры искали на соответствие полностью триптическим и полуптиптическим пептидам с максимум двумя пропущенными сайтами расщепления с толерантностью по массе 0,04 Да. Карбамидометилирование (+57,021464 Да) было установлено как фиксированная модификация для всех цистеинов, а окисление (+15,994915 Да) считалось необязательной модификацией для метионинов.Результаты поиска были обработаны с использованием Peptide Prophet (TPP версии 4.5.0) [36] для моделирования правильного и неправильного совпадения пептидного спектра (PSM). Основываясь на стратегии поиска цели-приманки [37], было определено строгое ограничение по количеству баллов, что привело к оценке вероятности ложного обнаружения (FDR) менее 0,2% на уровне PSM. PSM выше этого порогового значения были классифицированы с помощью программного обеспечения PeptideClassifier [38].
Был сформирован минимальный список однозначных идентификаций белков (на основе пептидов классов 1a, 1b или 3a) и идентификаций групп белков, которые подразумевают одну генную модель (на основе пептидов классов 2a, 2b) (Таблица 1).Для пептидов класса 3b, которые подразумевают разные белки, кодируемые разными моделями генов, было определено минимально возможное количество групп белков, не идентифицированных пептидами с более высоким информационным содержанием. Для идентификации белка нам потребовалось как минимум два независимых PSM. Это привело к окончательному расчетному уровню FDR на уровне 1,3%. Исходные данные протеомных экспериментов будут доступны на PRIDE (http://www.ebi.ac.uk/pride/).
Для идентификации белка нам потребовалось как минимум два независимых PSM. Это привело к окончательному расчетному уровню FDR на уровне 1,3%. Исходные данные протеомных экспериментов будут доступны на PRIDE (http://www.ebi.ac.uk/pride/).
Для предсказания глобулярных белков мы использовали Globplot 2.3 (http://globplot.embl.de/) [39], для предсказания сигнальных пептидов SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/) [40].
Дифференциальный анализ экспрессии белков
Используя совпадения с поиском-ловушкой, совпадения пептидного спектра (PSM) были строго отфильтрованы до FDR менее 0,2%. Соответствующие пептиды были классифицированы с помощью программы PeptideClassifier [38]. Был создан минимальный список однозначных идентификаций белков (на основе пептидов классов 1a, 1b или 3a) и идентификации групп белков, которые подразумевают одну генную модель (на основе пептидов классов 2a, 2b) (Таблица 1).Для пептидов класса 3b, которые подразумевают разные белки, кодируемые разными моделями генов, было определено минимально возможное количество групп белков, не идентифицированных пептидами с более высоким информационным содержанием.
Дифференциальный анализ экспрессии белка был проведен с помощью пакета R DESeq (версия 1.6.1) [41]) с использованием данных спектрального счета в качестве входных данных. На основе нормализованных данных подсчета DESeq смоделировал экспрессию гена / белка с отрицательным биномиальным распределением и создал список генов / белков, ранжированных в соответствии со статистической значимостью.Параметры по умолчанию были выбраны, как описано в виньетке пакета DESeq (для оценки дисперсии использовалась «локальная» подгонка).
Результаты и обсуждение
Гемолимфа была собрана у личинок штамма Oregon R дикого типа. Первую партию выделяли из личинок, полученных после сбора яиц в течение 2 часов и выдерживания в течение дополнительных 89 часов при 25 ° C в присутствии неограниченного количества стандартного корма Drosophila (фиг. 1A). Следовательно, во время выделения гемолимфы эти личинки должны были находиться на средней стадии L3.Оценка морфологии ротового крючка личинки, которая позволяет точно определить личиночную стадию, четко подтвердила, что все личинки достигли стадии L3 (n = 50). Mid L3 был выбран для сбора гемолимфы, так как на этой стадии происходит наиболее экстенсивный рост из всех развития Drosophila [33]. Для сравнения мы также проанализировали гемолимфу личинок идентичного возраста после воздействия голодания (рис. 1А). В течение последних 24 часов эта вторая партия личинок выдерживалась в присутствии 20% сахарозы, т.е.е. без источника аминокислот и других неуглеводных метаболитов. В начале голодания большинство личинок все еще находилось на стадии L2 в соответствии с морфологией ротового крючка (62,9% в L2, 5,6% во время линьки L2 / L3, 31,5% в L3; n = 54). Позже, во время выделения гемолимфы, все голодные личинки достигли стадии L3 (n = 50), но они были явно меньше кормленных личинок (рис. 1B). Более того, личинки, которые в дальнейшем содержались в условиях голодания, вместо того, чтобы быть принесенными в жертву для сбора гемолимфы, не окукливались, как кормленные личинки (рис.1С). Окукливание было либо блокировано (примерно на 30%), либо отсрочено (примерно на 70%). Куколки голодных личинок были меньше, чем куколки кормленных личинок (рис. 1D). Эти результаты подтверждают, что голодание началось в то время, когда большинство личинок еще не достигли так называемого критического веса. Известно, что голодание до достижения критического веса задерживает начало метаморфоза, тогда как более поздний голод больше не вызывает задержек [42].
Рис. 1. Протокол голодания и эффекты развития.
(A) Через 65 часов после откладывания яиц (AED) половину личинок перенесли в среду голодания (20% сахарозы). Двадцать четыре часа спустя гемолимфа от сытых и голодных личинок была собрана для глубокой протеомики дробовика. Также указывается время развития титра экдизона, стадии L2 и L3 личинки, приобретение критического веса, блуждающее поведение и окукливание в оптимальных условиях. Цифры указывают время в часах AED. (B) Размер накормленных и голодных личинок во время сбора гемолимфы.(C) Через 65 часов AED личинки были либо переведены на среду для голодания, либо в дальнейшем содержались на богатой среде с последующим анализом доли куколок с течением времени (n = 278 накормленных и 141 голодных) (D) Размер куколок, образованных в результате кормления или голодные личинки. Прутки = 0,5 мм.
https://doi.org/10.1371/journal.pone.0067208.g001
Для выделения гемолимфы личинки осторожно вскрывали щипцами для высвобождения неразбавленной гемолимфы, которую быстро выделяли без удаления гемоцитов.По сравнению с кормящимися личинками, концентрация белка в гемолимфе, выделенной от голодных личинок, была примерно в два раза ниже в двух независимых экспериментах. Анализ с помощью SDS-PAGE показал, что гемолимфа голодных личинок содержала гораздо более низкие уровни преобладающих белков гемолимфы с кажущейся молекулярной массой около 80 кДа (рис. 2). Эти белки личиночной сыворотки (Lsp1α, Lsp1β, Lsp1γ и Lsp2) сильно активируются на стадии L3. Их количество в гемолимфе личинок блуждающей стадии третьего возраста, выращенных на богатой среде, составляет до 70% от общего белка гемолимфы [43], [44], [45].
Рисунок 2. Изобилие личиночных белков сыворотки.
Гемолимфа была выделена из кормленных (е) и голодных (ых) личинок (см. Рис. 1). Белки в образцах гемолимфы объемом 10, 3,3, 1,7 или 1 мкл разделяли с помощью SDS-PAGE и окрашивали кумасси синим. Положение основных белков личиночной сыворотки (LSP) указано стрелкой. Положение и размер (кДа) маркеров молекулярной массы (m) указаны справа.
https://doi.org/10.1371/journal.pone.0067208.g002
Образцы гемолимфы анализировали на масс-спектрометре Orbitrap XL (рис. 3A). Пептиды были классифицированы с использованием детерминированной схемы классификации [38], [46] (Таблица S1). В двух образцах мы идентифицировали в общей сложности 6734 уникальных пептида, соответствующих белковым продуктам из 725 различных генных моделей с FDR 1% (таблица 1, рис. 3B). 75% (545 генных моделей) были обнаружены в гемолимфе как от кормленных, так и от голодных личинок. 10% (74 генных модели) были обнаружены только в гемолимфе от кормленных личинок, в то время как 25% (106 генных моделей) наблюдались только в гемолимфе от голодных личинок, у которых также было обнаружено большее общее количество различных генных моделей (651 против 619). .Предыдущие анализы протеома гемолимфы Drosophila [11], [12], [14], [16], [17], [18], [47] были значительно менее полными. В целом эти более ранние исследования выявили только 13% генных моделей, выявленных в нашем анализе. 90% ранее идентифицированных белков гемолимфы также были обнаружены в нашем исследовании. Подавляющее большинство этих ранее описанных белков являются очень многочисленными компонентами гемолимфы, как следует из спектрального подсчета [48] (Таблица S2). Точно так же предыдущие анализы протеома гемолимфы у других насекомых (включая пчелу Apis mellifera , тутового шелкопряда Bombyx mori и табачного рогатого червя Manduca sexta ) имели сравнительно ограниченный объем, выявляя преимущественно многочисленные компоненты [10] , [15], [19], [24], [49], [50], [51], [52], [53], [54].
Рис. 3. Характеристика протеома личиночной гемолимфы.
(A) Рабочий процесс анализа. Образцы гемолимфы от накормленных и голодных личинок переваривали в растворе. Триптические пептиды разделяли изоэлектрическим фокусированием для уменьшения сложности. Пептиды анализировали с помощью микрокапиллярной жидкостной хроматографии — ионизации с электрораспылением — тандемной МС (µLC-ESI-MS / MS). Спектральный поиск SEQUEST был выполнен для сопоставления пептидного спектра. (B) Диаграмма Венна, иллюстрирующая количество генных моделей, обнаруженных в гемолимфе от кормленных и голодных личинок, соответственно.
https://doi.org/10.1371/journal.pone.0067208.g003
Значительное увеличение количества идентифицированных белков гемолимфы в результате нашего анализа у личинок Drosophila приближает сложность этого протеома к описанному диапазону для широко проанализированного протеома плазмы человека. Проект протеома плазмы человека обнаружил очень неизбыточный набор из 1929 белковых последовательностей при 1% FDR [55]. И в плазме человека, и в гемолимфе личинок Drosophila содержание белка варьирует в очень широком диапазоне.Концентрация (~ 40 мг / мл) наиболее распространенного белка в плазме крови человека, сывороточного альбумина, сопоставима с концентрацией наиболее распространенного компонента гемолимфы личинок Drosophila , главного аполипопротеина Rfabg [56], [57]. С помощью интенсивной протеомики «дробовика» в плазме человека были идентифицированы белки с концентрацией более чем на 6,5 порядков ниже. Тем не менее, протеомика дробовика имеет явные ограничения, особенно в случае белков с низким содержанием. Известно, что некоторые белки плазмы человека имеют концентрации, которые более чем на 10 порядков ниже, чем наиболее распространенные компоненты, и в целом известные белки с низким содержанием не обнаруживаются с помощью протеомики дробовика [55], [58].Более того, в этом подходе низкая численность является лишь одним из нескольких ограничивающих факторов, при этом размер белка и отсутствие подходящих сайтов расщепления трипсином входят в число дополнительных решающих детерминант обнаружения. Таким образом, нельзя ожидать, что наш белковый каталог гемолимфы личинок Drosophila будет полным, и отсутствие некоторых известных компонентов гемолимфы явно очевидно. Например, мы не обнаружили инсулиноподобных пептидов, кодируемых генами dilp . Dilps 2, 3 и 5 высвобождаются в гемолимфу из специализированных нейросекреторных клеток в мозгу личинок в ответ на поглощение питательных веществ и предположительно действуют в наномолярных концентрациях [30], [31].Точно так же мы не обнаружили Upd2 / Leptin, который секретируется из жирового тела в ответ на поглощение питательных веществ и запускает высвобождение Dilp 2/5 нейросекреторными клетками мозга [29]. Обнаружение и количественная оценка компонентов с очень низким содержанием потребуют различных целенаправленных подходов [32], [59], [60], [61]. Более того, истощение количественно доминирующих компонентов является дополнительной стратегией, позволяющей производить более глубокий отбор проб. Поскольку Drosophila Lsp нулевые мутанты жизнеспособны и фертильны [45], анализ их гемолимфы может еще больше увеличить общий протеомный охват в будущих исследованиях.
В отличие от Dilps и Upd2, мы легко обнаружили другие белки, которые, как предполагалось, действуют как факторы роста. Например, мы четко наблюдали продукты всех шести Drosophila членов семейства генов Imaginal Disc Growth Factors ( Idgf1-5 , CG5210 ). Фактически, наши данные предполагают, что эти белки, связанные с хитиназой, являются обильными компонентами гемолимфы (среди первых 10%) у сытых и голодных личинок. Первоначально IDGF были идентифицированы в кондиционированной среде из-за их активности, стимулирующей рост клеток Drosophila cl8 [62], [63].Кроме того, мы также обнаружили в гемолимфе связанный с аденозиндезаминазой фактор роста А (Adgf-A). Adgf-A является основным регулятором внеклеточного аденозина на личиночных стадиях и, как было показано, играет важную роль в контроле пролиферации гемоцитов [64], [65], [66].
Наш протеом гемолимфы содержит несколько белков, которые не были обнаружены в предыдущих анализах, но недавно было показано, что они являются белками гемолимфы после первоначальной идентификации с помощью генетических подходов, пока наша работа продолжалась.К этой группе относятся, например, минорные аполипопротеины apoLTP / CG15828 и Cv-d / CG31150 [57], [67].
Чтобы проиллюстрировать потенциал нашего каталога белков гемолимфы для сбора данных и будущего функционального анализа, мы составили список потенциальных новых цитокинов (Таблица S2). Для этого списка мы отфильтровали все числа CG, которые, как было предсказано, кодируют глобулярный секретируемый белок меньше 400 аминокислотных остатков. Более того, мы оставили только те компоненты, о которых, согласно нашим сведениям, еще не сообщалось, что они являются компонентами гемолимфы.В результате был получен список из 30 записей, которые, возможно, заслуживают дальнейшего анализа. Два из этого списка (CG15201 и CG31997) — это белки семейства SVC, у которых есть мотив, изначально предполагаемый как связанный с инсулиноподобным фактором роста (IGF), но позже классифицированный как более похожий на C-домен фактора фон Виллебранда (VWC). [68].
Поскольку наша процедура выделения гемолимфы не включала удаление гемоцитов, ожидалось обнаружение некоторых цитозольных и ядерных белков. Более того, поскольку личиночные ранения были задействованы в нашей процедуре выделения гемолимфы, повреждение тканей и последующий разрыв кристаллических клеток могли усилить высвобождение несекретируемых клеточных белков, таких как гистоны и рибосомные белки, в гемолимфу [69], [70], [71] ].В какой степени такое высвобождение происходит даже при невозмущенном развитии личинок Drosophila , неизвестно. Несекретируемые клеточные белки, обнаруженные в нашей работе, могли, следовательно, происходить из включенных интактных гемоцитов, а также в результате лизиса гемоцитов и других клеток до или во время выделения гемолимфы. Надежное выяснение происхождения несекретируемых клеточных белков потребует дополнительных экспериментов и будет зависеть от методов с чувствительностью обнаружения выше, чем протеомика дробовика, особенно в случае тех, которые обнаруживаются только одним или несколькими пептидами.Предварительная оценка, основанная на нашем подсчете гистоновых пептидов и данных PaxDb относительно людей [72], предполагает, что утечка ткани в наши образцы гемолимфы произошла в сопоставимой степени, как это очевидно в случае человеческой плазмы. Более того, если предположить, что наш 24-часовой период голодания не оказал значительного влияния на клеточные уровни рибосомных белков, численное сравнение всех однозначных пептидов, полученных из рибосомных белков (297 в сытых, 264 голодающих), предполагает, что высвобождение несекретированных клеточных белков. белков в наших двух образцах произошло в сопоставимой степени.
Чтобы идентифицировать белки с различным содержанием в гемолимфе от накормленных и голодных личинок, соответственно, мы сравнили спектральные подсчеты с помощью DESeq [41] (рис. 4, таблица S3). Спектральный подсчет — это лишь приблизительная мера численности. Более того, интерпретация наших спектральных подсчетов должна учитывать, что общая концентрация белка в гемолимфе от кормленных и голодных личинок не идентична. Как указано выше, содержание белка в гемолимфе от голодных личинок вдвое ниже по сравнению с кормленными личинками, главным образом из-за отсутствия белков личиночной сыворотки у голодных личинок.Поскольку мы проанализировали одинаковое количество общего белка для пробы с кормлением и голоданием, нормализация не является тривиальной. Мы подчеркиваем, что различия в содержании белка, предполагаемые нашими данными, могут не обязательно отражать реальность, в частности, в случае белков с низким спектральным счетом, где систематическая ошибка выборки и непредвиденные обстоятельства, а также проблемы с нормализацией могли вызвать искажения. Как следствие, мы ограничиваем наши следующие комментарии случаями с предполагаемыми различиями в концентрации, которые были гораздо более обширными, чем двукратные, а также очевидными в независимой биологической копии, нашем первоначальном меньшем пилотном эксперименте.Для этих белков статистическая поддержка дифференциальной численности была очень сильной. Первые 10% дифференциально регулируемых белков, являющихся результатом 40 генов, собраны в таблице 2 (полный набор данных см. В таблице S3).
Рис. 4. Влияние голодания на протеом гемолимфы.
График зависимости величины от амплитуды (MA) показывает log2-кратное изменение экспрессии идентифицированных белков D. melanogaster в условиях голодания по сравнению со средним нормализованным спектральным числом.Выделены верхние 10% дифференциально экспрессируемых белков, включая 50 белков с повышенной активностью (красные точки) и 22 белка с пониженной регуляцией (зеленые точки). Идентификаторы белков показаны для выбранных белков, обсуждаемых в тексте. Однозначные определения белков по пептидам классов 1a, 1b и 3a показаны полными кружками. Белковые группы, идентифицированные пептидами класса 2a или 2b (которые однозначно подразумевают генную модель), показаны светлыми кружками, неоднозначная идентификация пептидами 3b показана светлыми ромбами (соответствующие идентификаторы перечислены в таблице S2).
https://doi.org/10.1371/journal.pone.0067208.g004
Наименьшее значение p (p <4.55E-05) было получено в случае Lsp1α, где было обнаружено почти 3000 спектров в гемолимфе после еды и только 9 спектры в образце от голодных личинок (Таблица S3). Сильные различия наблюдались также в случае близкородственных Lsp1β, Lsp1γ и Lsp2. Эти данные подсчета согласуются с нашими независимыми доказательствами анализа образцов гемолимфы с помощью SDS-PAGE и окрашивания кумасси синим (рис.2). Это также полностью согласуется с предсказаниями, основанными на продемонстрированной задержке развития, вызванной нашим протоколом голодания (Fig. 1A) и известной регуляцией развития этих основных Lsps во время развития в богатой среде [44], [45]. Поскольку во время сбора гемолимфы голодные личинки, в отличие от кормящей когорты, еще не достигли стадии, когда экспрессия Lsp является максимальной, ожидается, что уровень основных Lsps будет снижен у голодных личинок. Мы пришли к выводу, что в случае Lsps спектральный подсчет с нашими данными дал надежную информацию о численности.
Drosophila Lsps были первоначально идентифицированы из-за их высокой численности в гемолимфе личинок блуждающей стадии третьего возраста [73], [74], [75]. Было показано, что они служат в качестве запасных белков, которые метаболизируются во время блуждания личинок без кормления и стадий куколки (обзоры см. [75], [76], [77]. Гомологи встречаются у всех насекомых и обычно обозначаются как гексамерины, поскольку они образуют гомо- и гетеромерные гексамеры.При подготовке к стадиям отсутствия кормления экспрессия Lsps Drosophila сильно индуцируется в жировом теле личинок среднего третьего возраста повышением титра экдизона.Помимо традиционного фокуса внимания на этом впечатляющем пике экспрессии Lsp перед не питающимися поздними стадиями личинки и куколки, недавние данные свидетельствуют о том, что Lsps также экспрессируется во время других стадий, хотя и на значительно более низких уровнях. Несколько экспериментов с микрочипами ясно продемонстрировали присутствие, в частности, транскриптов Lsp1β и Lsp2 у взрослых мух. Более того, эти два гена были среди тех, которые наиболее сильно и последовательно подавлялись после 24-часового голодания взрослых мух [78], [79].Поэтому мы предлагаем использовать эти гены Lsp для хранения питательных веществ в ожидании приближающегося голодания, не только перед стадиями развития без кормления, когда они регулируются экдизоном, но и во взрослой жизни, где они, по-видимому, контролируются доступностью питательных веществ во время циклов застолья. или голод. Таким образом, сильно сниженное содержание Lsp в гемолимфе голодных личинок может отражать не только косвенное влияние голодания на развитие, но и более прямую регуляцию, не связанную с развитием, питательными веществами.
Пять генных моделей ( Yp3 , Fbp1 , Fbp2 , CG7320 , Obp99b ) были идентифицированы с характерным сходством с основными генами Lsp ( Lsp1α, β, γ и Lsp2 2). Продукты этих генных моделей также отсутствовали или были значительно ниже в гемолимфе голодных личинок. Более того, согласно профилированию экспрессии во время развития в богатой среде [80], их уровни транскриптов сильно повышаются у личинок в конце третьего возраста, что совпадает с усилением экспрессии гена Lsp.Следовательно, сильно сниженная концентрация соответствующих белков в гемолимфе предположительно отражает, по крайней мере, частично ингибирующий эффект голодания на развитие. Однако мы отмечаем, что транскрипты Obp99b , как было обнаружено, также сильно и постоянно подавлялись в ответ на голодание у взрослых [78], [79], как в случае Lsp1β и Lsp2 . Мы предполагаем, что продукт Obp99b , который характеризуется профилем онтогенетического транскрипта, совершенно отличным от других родственных пахучих связывающих белков [80], может функционировать как запасной белок.В поддержку этого предложения большинство других моделей генов ( CG7320 , Fbp1 , Fbp2 и Yp3 ), которые в отношении профиля экспрессии онтогенеза в богатой среде и зависимости содержания белка в гемолимфе от личинок кормление ведет себя как гены Obp99b, и Lsp, имеют тесные функциональные связи с запасными белками. CG7320 кодирует не охарактеризованный минорный белок, родственный гексамерину. Белок 1 жирового тела (Fbp1) служит рецептором для реимпорта гексамерина в жировое тело для производства гранул для хранения белка [81].Yp3 — это белок желтка, который, как известно, используется для хранения при приготовлении перед стадией эмбриогенеза, не требующей питания [82].
Другая половина генных моделей, кодирующих белковые продукты, которые отсутствовали или уменьшались в гемолимфе голодных личинок (Таблица 2), не принадлежала к группе с сильной активацией транскрипции, подобной Lsp , во время третьего личиночного возраста. Поэтому их пониженное содержание в голодной гемолимфе не является отражением тормозящего эффекта голодания на развитие.Три из этих генных моделей ( Npc2h , Tsf1 , Pxn ), как было обнаружено ранее, подавлялись голоданием у взрослых в соответствии с транскриптомным анализом [78].
Помимо 17 моделей генов, характеризующихся пониженным содержанием белковых продуктов в гемолимфе голодных личинок, мы обнаружили 23 модели генов с противоположным поведением (таблица 2 и S2) с использованием строгих критериев, описанных выше. Судя по профилям транскриптов развития [80], повышенное содержание продуктов в гемолимфе от голодных личинок в этих случаях вряд ли будет вторичным следствием ингибирующего эффекта голодания на развитие, за двумя возможными исключениями: Cpr51A и CG30457 .Более того, в отличие от белков, сниженных в голодной гемолимфе, где очевидна четкая корреляция с данными транскриптомики из экспериментов по голоданию взрослых [78], [79], этого не было в случае белков, обогащенных голодной гемолимфой. Хотя было обнаружено, что голодание у взрослых сопровождается подавлением транскрипции генов защиты и иммунного ответа [78], наши протеомические данные по гемолимфе личинок не выявили такого же ответа. Некоторые из белков, обогащенных голодной гемолимфой, действительно участвуют в защите и иммунитете (Sp7, PO45, GNBP3, Spn55B, Spn77Ba).Помимо Spn55B и 77Ba, все другие обнаруженные серпины (Spn4, Spn5, Spn27a, Spn88Eb, Spn43Ab, Spn28D, Spn1, Spn42E), за исключением Spn1, по-видимому, также были обогащены гемолимфой от голодных личинок, хотя и с более слабой статистической поддержкой. Белки суперсемейства серпинов участвуют в регуляции множества различных быстрых физиологических реакций, часто действуя как ингибиторы протеаз [83]. Однако, учитывая небольшое количество случаев с надежной статистической поддержкой, общие выводы о влиянии голодания на защитные и иммунные или любые другие процессы у личинок невозможны.Анализ онтологии генов также не смог выявить статистически значимых различий между протеомами гемолимфы голодных и накормленных личинок.
Мы хотели бы отметить, что наши данные также должны представлять значительный интерес для дальнейшего улучшения аннотации генома Drosophila , которая до сих пор в значительной степени основана на анализе транскриптов и смещении для длинных открытых рамок считывания.
Выводы
Для белков с высоким и средним содержанием наше исследование дает первое исчерпывающее представление о составе протеома гемолимфы у личинки Drosophila .Наши данные приближают известную композиционную сложность гемолимфы Drosophila к состоянию широко охарактеризованного протеома плазмы человека. Наш протеом гемолимфы будет поддерживать интеллектуальный анализ данных в будущем. Каталог пептидов (Таблица S1) может дать инструкции для будущих количественных сравнений уровней белков гемолимфы на разных стадиях развития и физиологических условиях с использованием подходов целевой протеомики. Наше первоначальное сравнение гемолимфы от накормленных и голодных личинок с помощью спектрального подсчета показало, что уровень по крайней мере некоторых белков в гемолимфе личинок Drosophila сильно зависит от статуса питания.Известных запасных белков было гораздо больше в гемолимфе от кормления по сравнению с голодными личинками. Поскольку подавляющий эффект голодания на развитие личинок, по-видимому, усиливает первичный ответ на состояние питания, наше сравнение эффективно указывает на новые запасные белки-кандидаты.
Для большинства людей есть насекомые — это только естественно
Если вы думаете, что есть насекомых — это отвратительно, вы можете относиться к культурному меньшинству. На протяжении всей истории люди смаковали насекомых в пищу. Сегодня во многих культурах все еще так.
Десять тысяч лет назад охотники и собиратели ели насекомых, чтобы выжить. По словам Джина ДеФолиара, заслуженного профессора энтомологии Университета Висконсин-Мэдисон, они, вероятно, узнали, что было съедобным, наблюдая за тем, что ели животные.
«Поедание насекомых — это, безусловно, давняя традиция», — сказал он.
Древние римляне и греки обедали насекомыми. Плиний, римский ученый первого века и автор книги Historia Naturalis, писал, что римские аристократы любили есть личинок жуков, выращенных на муке и вине.
Аристотель, греческий философ и ученый четвертого века, описал в своих трудах идеальное время для сбора цикад: «Личинка цикады, достигнув полного размера в земле, становится нимфой; тогда она имеет лучший вкус, прежде чем шелуха распадается. сломано. Сначала лучше есть самцов, но после совокупления самок, которые потом полны белых яиц ».
Ветхий Завет побуждал христиан и евреев есть саранчу, жуков и кузнечиков. Говорят, что святой Иоанн Креститель выжил на саранче и меде, когда жил в пустыне.
В середине 19 века майор Говард Иган, суперинтендант Пони-экспресса в Неваде, наблюдал за охотой на индейцев пайутов, где добычей не было ни бизона, ни кролика, а скорее бескрылого мормонского сверчка.
Майор Иган позже описал, как пайют вырыли ряд больших траншей, засыпали их соломой, а затем загнали полчища сверчков в выкопанную ловушку. Индейцы подожгли солому, сжигая сверчков заживо.
Женщины пайуте затем собрали бушели обугленных жуков и принесли их обратно в лагерь, чтобы приготовить муку для хлеба — важный сезонный источник белка.
Кухня с насекомымиСегодня в меню встречаются многие виды насекомых. По словам ДеФолиара, жуки остаются традиционной пищей во многих культурах Африки, Азии и Латинской Америки.
В Гане во время весенних дождей крылатых термитов собирают и жарят, жарят или превращают в хлеб. В Южной Африке насекомых едят с кукурузной кашей.
В Китае пчеловоды считаются зрелыми, потому что они регулярно поедают личинок из своих ульев.
Гурманы в Японии отведают личинок водных мух, обжаренных в сахаре и соевом соусе.Вареные в кокосовом молоке с имбирем и чесноком стрекозы без крыльев — деликатес на Бали.
Личинки смакуют в Новой Гвинее и аборигенной Австралии. В Латинской Америке в традиционных блюдах преобладают цикады, жареные на огне птицееды и муравьи. Одно из самых известных кулинарных насекомых, червь агавы, едят на лепешках и помещают в бутылки с ликером мескаль в Мексике.
Культурный выборНо, несмотря на давнюю традицию — и нынешнюю популярность, по крайней мере, у половины народов мира — употребление насекомых в пищу все еще редко, не говоря уже о табу, в Соединенных Штатах и Европе.
Одна из причин, по словам ДеФолиара, заключается в том, что после того, как Европа стала аграрной, насекомые стали восприниматься как разрушители урожая, а не как источник пищи.
«Мы инвестировали в животноводство, а насекомые стали врагами», — сказал Дэвид Джордж Гордон, биолог и автор книги The Eat-a-Bug Cookbook.
Манфред Крогер, почетный профессор пищевых наук в Университете штата Пенсильвания в Юниверсити-парке, говорит, что то, что люди предпочитают есть, обусловлено культурой.
Многие жители Запада охотно едят креветок и омаров (которые, как и насекомые, являются членистоногими), а также свинину и устрицы — продукты, которые в других культурах отвергаются как грязные.
«У нас есть от 200 до 300 основных продуктов питания, которые мы передаем из поколения в поколение, и пробовать новые продукты — всегда щекотливая тема», — сказал Крогер.
«Eco Protein»Крогер — совсем не одинокий голос в пустыне, когда он утверждает, что поедание насекомых дает много питательных преимуществ.
Гамбургер, например, примерно на 18 процентов состоит из белка и на 18 процентов из жира. Между тем, приготовленный кузнечик содержит до 60 процентов белка и всего 6 процентов жира.Кроме того, как и в случае с рыбой, жирные кислоты насекомых ненасыщены и поэтому более полезны для здоровья.
ДеФолиарт, энтомолог из Висконсина, говорит, что насекомые не только питательны и вкусны, но и могут быть экологически чистым источником потребности человека в белке.
«Занимаясь скотоводством, мы лишили планету растительности», — сказал ДеФолиар. «Насекомые гораздо эффективнее превращают биомассу в белок».
Разведение насекомых, возможно, намного более эффективно, чем животноводство.Из ста фунтов (45 кг) корма получается 10 фунтов (4,5 кг) говядины, а из того же количества корма получается 45 фунтов (20 кг) сверчка.
Отмечая широкое использование пестицидов в промышленном сельском хозяйстве, ДеФолиарт сказал: «Люди отравляют планету, избавляя ее от насекомых, вместо того, чтобы поедать насекомых и не допускать попадания искусственных химикатов в растения, которые мы едим».
Таксономия и систематика личинок индо-тихоокеанских рыб: обзор прогресса с 1981 г.
Эйбл К.В., Фахей М.П. (1998) Первый год жизни эстуарных рыб в Средней Атлантической бухте.Rutgers University Press, Нью-Брансуик, Нью-Джерси
Ahlstrom EH, Moser HG (1976) Яйца и личинки рыб и их роль в систематических исследованиях и в рыболовстве. Revue des Travaux de l’Institut des Peches Maritimes 40: 379–398
Ahlstrom EH, Moser HG (1981) Систематика и развитие ранних стадий жизненного цикла морских рыб: достижения за прошедшее столетие, текущее состояние и предложения по будущее. Rapports et Proces-Verbaux des Reunions Conseil International pour L’Exploration de la Mer 178: 541–546
Анонимный редактор (1985) Отчеты об исследованиях личинок рыб.Серия Совета по сельскохозяйственному рыболовству [Тайвань] 2: 1–279
Baensch F (2014) Фотография голубого рифа. http://www.bluereefphoto.org/. По состоянию на апрель 2014 г.
Baldwin CC, Johnson GD (1993) Phylogeny of the Epinephelinae (Teleostei: Serranidae). Bull Mar Sci 52: 240–283
Baldwin CC, Mounts JH, Smith DG, Weigt LA (2008) Генетическая идентификация и описание окраски ранних стадий жизненного цикла белизовского Phaetoptyx и Astrapogon (Teleostei: Apogonidae ) с комментариями к идентификации взрослого Phaetoptyx .Zootaxa: 1–22
Beltran-Leon BS, Herrera RR (2000) Estadios tempranos de peces del pacifico Colombiano. Instituto Nacional de Pesca y Acuicultura, Буэнавентура, Колумбия
Бертельсен Э., Маршал Н. Б. (1956) Мирапиннати, новый отряд рыб. Dana Report 42: 1–34
Бритц Р., Джонсон Г.Д. (2012) Онтогенез и гомология скелетных элементов, которые образуют сосательный диск ремор (Teleostei, Echeneoidei, Echeneidae). J Morphol 273: 1353-1366
Brownell CL (1979) Этапы раннего развития 40 видов морских рыб с пелагической икрой с мыса Доброй Надежды.Ихтиоловый бык JLB Smith Inst Ichthyol 40: 1–84
Chayakul R (1990) Личинки и молодь рыб, обитающие в Сиамском заливе. Технический доклад Группы исследования морских ресурсов, Отдел морского рыболовства, Таиланд Dep Fisher 4/190: 1–98
Chiu T-S (1999) Личинки и молодь рыб Тайваня. Национальный музей морской биологии и аквариум, Кентинг
Collet A, Bosc P, Pothin K, Chabanet P (2013) Guide d’identification des post-larves de poissons des récifs coralliens.Иль-де-ла-Реюньон ARDA et OCEAN Consult ’, Ла-Реюньон
Коннелл А.Д. (2012 г.) Икра и личинки морских рыб с восточного побережья Южной Африки. http://www.fisheggsandlarvae.com/. По состоянию на апрель 2014 г.
D’Avella MJ (2014) Мэтью Дж. Д’Авелла — плотник и фотограф природы. http://www.konawoodworking.com/. По состоянию на апрель 2014 г.
Delsman HC (1972) Икра и личинки рыб из Яванского моря [перепечатка статей Дельсмана за 1921–1938 гг. В Treubia].Linnaeus Press, Амстердам
Дои М., Коно Х., Таки Й., Оно А., Сингхагрейван Т. (1994) Морфологическое развитие яиц, личинок и молоди красного луциана, Lutjanus argentimaculatus (Pisece: Lutjanidae). J Tokyo Univ Fisher 81: 135–153
Eschmeyer WN (ed) (2014) Каталог рыб: роды, виды, ссылки. Электронная версия. Калифорнийская академия наук, Сан-Франциско. http://research.calacademy.org/research/ichthyology/catalog/fishcatmain.жерех По состоянию на апрель 2014 г.
Eschmeyer WN, Fricke R, Fong JD, Polack DA (2010) Разнообразие морских рыб: история знаний и открытий (Рыбы). Zootaxa 2525: 19–50
Fahay MP (1983) Справочник по ранним стадиям морских рыб, обитающих в западной части Северной Атлантики, от мыса Хаттерас до южного шельфа Шотландии. J Northwest Atl Fish Sci 4: 1–423
Fahay MP (2007) Ранние стадии развития рыб в западной части северной части Атлантического океана (пролив Дэвиса, южная Гренландия и Фламандская шапка до мыса Хаттерас).Организация по рыболовству в северо-западной части Атлантического океана, Дартмут, NS
Fourmanoir P (1971) Notes ichthyologiques (III). Cahiers ORSTOM, series Oceanographie 9: 267–278
Fourmanoir P (1976) Формы после личинок и молодняк пуассоновских котов, содержащихся в пелагическом шалете в южной части Тихого океана. Cahiers du Pacifique 19: 47–88
Hay AC, Leis JM (2011) Пелагическая личинка полуночного окуня, Macolor macularis (Teleostei: Lutjanidae).Rec Aust Mus 63: 85–88
Hilton EJ, Johnson GD (2007) Когда два равны трем: остеология развития хвостового скелета у карангидных рыб (Perciformes: Carangidae). Evol Dev 9: 178–189
Hilton EJ, Johnson GD, Smith-Vaniz WF (2010) Остеология и систематика Parastromateus niger (Perciformes: Carangidae) с комментариями по скелету спинной жаберной дуги карангида. Copeia 2010: 312–333
Houde ED, Almatar S, Leak JC, Dowd CE (1986) Численность и разнообразие ихтиопланктона в Западной Персидском заливе.Kuwait Bull Mar Sci 8: 107–393
Hubert N, Delrieu-Trottin E, Irisson JO, Meyer C, Planes S (2010) Идентификация личинок коралловых рифовых рыб с помощью штрих-кодирования ДНК: контрольный пример с семействами Acanthuridae и Holocentridae . Mol Phylogen Evol 55: 1195–1203
Hubert N, Espiau B, Meyer C, Planes S (2014) Идентификация ихтиопланктона кораллового рифа с помощью штрих-кодов ДНК. Mol Ecol Resour doi: 10.1111 / 1755-0998.12293
Икеда Т., Хираи А., Табата С., Ониши Ю., Мито С. (2014) Определитель рыбной икры в Японии.В: Okiyama M (ed) Атлас рыб ранних стадий в Японии, второе издание. Tokai University Press, Hadano, pp 1–108
Iwatsuki Y (2013) Обзор комплекса Acanthopagrus latus (Perciformes: Sparidae) с описаниями трех новых видов из Индо-западной части Тихого океана. J Fish Biol 83: 83–95
Iwatsuki Y, Heemstra PC (2010) Таксономический обзор западных видов Индийского океана из рода Acanthopagrus Peters, 1855 (Perciformes, Sparidae), с описанием нового вида из Оман.Copeia 2010: 123–136
Jeyaseelan MJP (1998) Руководство по икрам и личинкам рыб из водоемов азиатских мангровых зарослей. ЮНЕСКО, Париж
Johnson GD (1988) Niphon spinosus , примитивный эпинефелиновый серранид: подтверждающие данные по личинкам. Jpn J Ichthyol 35: 7–18
Johnson GD, Paxton JR, Sutton TT, Satoh TP, Sado T, Mishida M, Miya M (2009) Глубоководная тайна раскрыта: удивительные трансформации личинок и экстремальный половой диморфизм объединяют три рыбные семейства.Biol Lett 5: 183–187
Джонсон Р.К., Бертельсен Э. (1991) Рыбы семейства Giganturidae: систематика, развитие, распространение и аспекты биологии. Dana Report 91: 1–45
Jones PW, Martin FD, Hardy JD, Johnson GD, Fritzsche RA, Drewry GE (eds) (1978) Развитие рыб Срединно-Атлантического залива: атлас яиц, личинок , и ювенильные стадии. Министерство внутренних дел США, Вашингтон
Джонс С., Бенсам П. (1968) Аннотированная библиография по местообитаниям и развитию рыб в индийском регионе.Бюллетень Central [Indian] Mar Fisher Inst 3: 1–154 (доступно по адресу: http://repository.ias.ac.in/33373/33371/33373.pdf)
Jones S, Kumaran M (1962) ) Примечания по икре, личинкам и молоди рыб из индийских вод: XII. Myripristis murdjan (Форскал) и XIII. Holocentrus sp. Indian J Fish 9A: 155–167
Jones S, Kumaran M (1964) Примечания к икре, личинкам и молоди рыб из индийских вод: XV. Pegasus volitans Линней, XVI в. Dactyloptena orientalis (Кювье и Валансьен) и XVII в. Dactyloptena macracanthus (Бликер). Индийская рыба Дж. 11A: 232–246
Юнкер М. (2007) Молодые рыбы коралловых рифов островов Уоллис и центральная часть Тихого океана, руководство по идентификации. Департамент окружающей среды Уоллис и Футуна и Инициативы по коралловым рифам для Тихого океана (CRISP), Нумеа, Новая Каледония
Кендалл А.В. (2011) Идентификация яиц и личинок морских рыб. Tokai University Press, Hadano
Kendall AW, Ahlstrom EH, Moser HG (1984) Этапы истории ранней жизни рыб и их характеров.В: Moser HG, Richards WJ, Cohen DM, Fahay MP, Kendall AW, Richardson SL (eds) Онтогенез и систематика рыб. Американское общество ихтиологов и герпетологов, Лоуренс, Канзас, стр. 11–22
Кендалл А.В., Матарезе А.К. (1994) Статус описаний ранних этапов жизни морских костистых насекомых. Fish Bull 92: 725–736
Kingsford MJ (1988) История ранних этапов жизни рыб в прибрежных водах северной Новой Зеландии: обзор. NZ J Mar Freshwat Res 22: 463–479
Kinoshita I (2014) Определитель семейств морских личинок рыб в Японии.В: Okiyama M (ed) Атлас рыб ранних стадий в Японии, второе издание. Tokai University Press, Hadano, pp 1–82
Ko HL, Wang YT, Chiu TS, Lee MA, Leu MY, Chang KZ, Chen WY, Shao KT (2013) Оценка точности морфологической идентификации личинок рыб с помощью применение штрих-кодирования ДНК. PLoS One 8: e53451
Кодзима Дж. (1988) Lutjanidae. В: Okiyama M (ed) Атлас рыб ранней стадии в Японии. Tokai University Press, Tokyo, pp 511–517
Kon T, Yoshino T., Mukai T., Nishida M (2007) Последовательности ДНК идентифицируют многочисленные загадочные виды позвоночных: урок бычковидной рыбы Schindleria .Mol Phylogen Evol 44: 53–62
Кон Т., Йошино Т., Нишида М. (2011) Криптический вид бычковидного педоморфного рода Schindleria из Палау, Западная часть Тихого океана. Ichthyol Res 58: 62–66
Konishi Y, Chayakul R, Chamchang C, Duangdee T. (2012) Ранние стадии морских рыб в регионе Юго-Восточной Азии. Центр развития рыболовства в Юго-Восточной Азии, Самутпракан, Таиланд
Константинидис П., Джонсон Г.Д. (2012a) Сравнительное онтогенетическое исследование хвостового комплекса тетраодонтиформ.Acta Zool (Stockh) 93: 98–114
Konstantinidis P, Johnson GD (2012b) Онтогенез челюстного аппарата и суспензора Tetraodontiformes. Acta Zool (Stockh) 93: 351–366
Kotthaus A (1970) Flagelloserranus : новый род серранидных рыб с описанием двух новых видов (Pisces, Percomorphi). Dana Report 78: 1–32
Leis JM (1985) Обзор «Библиографии по идентификации икры, личинок и молоди морских прибрежных рыб Японии».Информационный бюллетень секции истории раннего периода жизни American Fisher Soc 6: 11–13
Leis JM (1986) Личиночное развитие четырех видов индо-тихоокеанской коралловой форели Plectropomus (Pisces: Serranidae: Epinephelinae) с анализом родовые отношения. Bull Mar Sci 38: 525–552
Leis JM (1993) Минимальные требования к опубликованным описаниям развития личинок рыб. Jpn J Ichthyol 40: 393–395
Leis JM (2005) Личинка этелинового лютианида, Randallichthys filamentosus (Pisces: Perciformes), с комментариями о филогенетических последствиях морфологии личинок базальных лютианид.Zootaxa 1008: 57–64
Leis JM (2007) Развитие личинок в подсемействе лютианидов Lutjaninae (Pisces): род Macolor . Rec Aust Mus 59: 1–8
Leis JM (2008) Развитие личинок в подсемействе лютианидов Lutjanidae: индо-тихоокеанский род Pinjalo . Zootaxa 1760: 37–49
Leis JM, Bray DJ (1995) Развитие личинок в подсемействе лютианидов Paradicichthyinae (Pisces): роды Symphorus и Symphorichthys .Bull Mar Sci 56: 418–433
Leis JM, Bullock S, Bray DJ, Lee K (1997a) Развитие личинок в подсемействе лютианидов Apsilinae (Pisces): род Paracaesio . Bull Mar Sci 61: 697–742
Leis JM, Carson-Ewart BM (eds) (2000) Личинки прибрежных индо-тихоокеанских рыб: руководство по идентификации (Fauna Malesiana Handbook 2). Brill, Leiden
Leis JM, Carson-Ewart BM (eds) (2004) Личинки прибрежных индо-тихоокеанских рыб: руководство по идентификации (Справочник Fauna Malesiana 2, 2-е издание).Brill, Leiden
Leis JM, Hay AC, Gaither MR (2011) Способность плавать и ее быстрое снижение при оседании у личинок губана (Teleostei: Labridae). Mar Biol 158: 1239–1246
Leis JM, Lee K (1994) Развитие личинок в подсемействе лютинидов Etelinae (Pisces): роды Aphareus , Aprion , Etelis и Pristipomoides. Bull Mar Sci 55: 46–125
Leis JM, Olney JE, Okiyama M (1997b) Труды симпозиума «Личинки рыб и систематика: онтогенез и взаимосвязи» Международной конференции по личинкам рыб, состоявшейся в Сиднее, июнь 1995 г. .Bull Mar Sci 60: 1–212
Leis JM, Rennis DS (1983) Личинки рыб коралловых рифов Индо-Тихоокеанского региона. Издательство Университета Нового Южного Уэльса и Университетское издательство Гавайев, Сиднея и Гонолулу
Лейс Дж. М., Трнски Т. (1989) Личинки индо-тихоокеанских прибрежных рыб. Издательство Университета Нового Южного Уэльса и Университетское издательство Гавайев, Сиднея и Гонолулу
Leis JM, Trnski T, Beckley LE (2002) Личиночное развитие Pagellus natalensis и то, что морфология личинок указывает на взаимоотношения в семействе окуневидных рыб Sparidae.Mar Freshwat Res 53: 367–376
Leis JM, Wright KJ, Johnson RN (2007) Поведение, которое влияет на расселение и связь у маленьких молодых личинок рифовых рыб. Mar Biol 153: 103–117
Leu M-Y, Liou C-H (2013) Личиночное развитие луциана Рассела, Lutjanus russellii (Teleostei: Lutjanidae), выращенного в лабораторных условиях. J Mar Biol Assoc UK 93: 1695–1701
Leu MY, Liou CH, Wang WH, Yang SD, Meng PJ (2009) Естественный нерест, раннее развитие и первое кормление полукруглой рыбы-ангела [ Pomacanthus semicirculatus (Cuvier , 1831)] в плену.Aquacult Res 40: 1019–1030
Loeb VJ (1979) Вертикальное распределение и развитие личинок рыб в центральном круговороте северной части Тихого океана летом. Fish Bull 77: 777–793
Maamaatuaiahutapu M, Remoissenet G, Galzin R (2006) Guide d’identification des larves de poissons récifaux de Polynésie française. Éditions Téthys, Taravao, Polynésie française
Marancik KE, Richardson DE, Lyczkowski-Shultz J, Konieczna M, Cowen RK (2010) Оценка морфологических признаков для идентификации морского окуня (Serranidae genius: Epinephelini) в Мексике с использованием личинок идентифицированные экземпляры.Bull Mar Sci 86: 571–624
Масуда Х., Кобаяши Й. (1994) Грандиозные варианты образа жизни рыб: изменение цвета японских рыб. Tokai University Press, Tokyo
Matarese A, Blood D, Bahl K, DeForest L, Konieczna M (2012) Информационная система по ихтиопланктону. Национальное управление океанических и атмосферных исследований. http://access.afsc.noaa.gov/ichthyo/index.php. По состоянию на апрель 2014 г.
Matarese AC, Kendall AWj, Blood DM, Vinter BM (1989) Лабораторный справочник по ранним этапам жизненного цикла рыб северо-восточной части Тихого океана.NOAA Tech Rep NMFS 80: 1–652
McCormick MI, Mackey L, Dufour V (2002) Сравнительное исследование метаморфоза у тропических рифовых рыб. Mar Biol 141: 841–853
Миллер Дж. М., Уотсон В., Лейс Дж. М. (1979) Атлас личинок обычных прибрежных морских рыб на Гавайских островах. Univ Hawaii Sea Grant College Program Прочие представители 80–02: 1–79
Миллер М.Дж., Цукамото К. (2004) Введение в биологию и идентификацию лептоцефалов. Институт океанологических исследований Токийского университета, Токио
Мито С., Сента Т., Окияма М., Синода М., Минами Т., Шимоно М. (ред.) (1980) Библиография по идентификации икры и личинок рыб в водах вокруг Японии.Японская ассоциация сохранения рыбных ресурсов, Токио
Mooi RD, Gill AC (2010) Филогении без синапоморфий — кризис в систематике рыб: время проявить некоторый характер. Zootaxa 2450: 26–40
Moser HG (1996) Ранние стадии развития рыб в районе Калифорнийского течения. Атлас исследований совместного океанического рыболовства Калифорнии 33: 1–1505
Moser HG, Ahlstrom EH (1970) Развитие фонарных рыб (семейство Myctophidae) в Калифорнийском течении, часть 1.Виды с узкоглазыми личинками. Бык Л.А. Граф Мус Натл Хист, Sci 7: 1–145
Moser HG, Ahlstrom EH (1973) Роль личиночных состояний в систематических исследованиях морских костистых: Myctophidae, тематическое исследование. Fish Bull 72: 391–413
Moser HG, Richards WJ, Cohen DM, Fahay MP, Kendall AW, Richardson SL (eds) (1984) Онтогенез и систематика рыб, специальная публикация № 1. Американское общество ихтиологов и герпетологов, Лоуренс, Канзас
Murphy BF, Leis JM, Kavanagh KD (2007) Личиночное развитие амбонской стрекозы ( Pomacentrus amboinensis ) с кратким описанием развития помацентрид.J Fish Biol 71: 569–584
Neira FJ, Miskiewicz AG, Trnski T (eds) (1998) Личинки австралийских рыб умеренного пояса: лабораторное руководство по идентификации личинок рыб. University of Western Australia Press, Nedlands
Nellen W (1973) Виды и численность личинок рыб в Аравийском море и Персидском заливе. Ecol Stud: Biol Indian Ocean 3: 415–430
Okiyama M (ed) (1988) Атлас рыб ранних стадий в Японии. Tokai University Press, Tokyo
Okiyama M (ed) (2014) Атлас рыб ранних стадий в Японии, второе издание.Tokai University Press, Hadano
Olivar MP, Fortuno JM (1991) Руководство по ихтиопланктону юго-восточной Атлантики (регион Бенгельского течения). Sci Mar (Barc) 55: 1–383
Olivar MP, Moser HG, Beckley LE (1999) Личинки рыбы-фонарика из течения Агульяс (юго-запад Индийского океана). Sci Mar (Barc) 63: 101–120
Ozawa T (ed) (1986) Исследования океанического ихтиопланктона в западной части северной части Тихого океана. Kyushu University Press, Fukuoka
Pegg GG, Sinclair B, Briskey L, Aspden WJ (2006) Идентификация штрих-кода MtDNA личинок рыб в южной части Большого Барьерного рифа, Австралия.Sci Mar (Barc) 70S2: 7–12
Reader SE, Leis JM (1996) Личиночное развитие в подсемействе лютианид Caesioninae (Pisces): роды Caesio, Dipterygonotus, Gymnocaesio и Pterocaesio Pterocaesio. Bull Mar Sci 59: 310–369
Richards WJ (1985) Статус идентификации ранних стадий жизни рыб. Bull Mar Sci 37: 756–760
Richards WJ (2006) Ранние стадии атлантических рыб: руководство по идентификации для западной центральной части Северной Атлантики.Тейлор и Фрэнсис, Бока-Ратон, Флорида
Ричардс В.Дж. (2008) Руководство по идентификации ранних стадий жизненного цикла рыб из вод Кувейта в Персидском заливе Индийского океана. Кувейтский институт научных исследований, Сафат, Кувейт
Rocha-Olivares A (1998) Мультиплексная гаплотип-специфическая ПЦР: новый подход к определению видов на ранних этапах жизни морских окуней богатого видами рода Sebastes Cuvier. J Exp Mar Biol Ecol 231: 279–290
Rocha-Olivares A, Moser HG, Stannard J (2000) Молекулярная идентификация и описание пелагического молодняка морских окуней Sebastes constellatus и Sebastes Ensifer .Fish Bull 98: 353–363
Schnell NK, Britz R, Johnson GD (2010) Новое понимание сложной структуры и онтогенеза затылочно-позвоночной щели у колючих стрекоз (Stomiidae, Teleostei). J Morphol 271: 1006–1022
Schwarzhans W., Møller PR, Nielsen JG (2005) Обзор Dinematichthyini (Teleostei: Bythitidae) Индо-западной части Тихого океана. Часть I. Diancistrus и два новых рода с 26 новыми видами. Бигль, Художественные галереи Рек-Муз, Северная территория 21: 73–163
Сеноу Х., Йошино Ю. (2002) Наблюдение за молодыми рыбками.Hankyu Communications, Tokyo
Шадрин А.М., Павлов Д.С., Астахов Д.А., Новиков Г.Г. (2003) Атлас икры и личинок прибрежных рыб Южного Вьетмана. Geos, Москва
Шао К.Т., Ян Дж.С., Чен К.С., Ли Ю.С. (2001) Справочник по идентификации икры морских рыб из Тайваня. Институт зоологии Academia Sinica и Тайваньская энергетическая компания, Тайбэй
Shimose T., Tachihara K (2005) Продолжительность появления и морфология молоди морского окуня Lutjanus fulviflammus вдоль побережья острова Окинава, Япония.Biol Mag Okinawa 43: 35–43
Smith DG (2014) Личиночные рыбы из Кэрри-Боу-Кей, Белиз — в цвете. http://vertebrates.si.edu/fishes/larval/index.html. По состоянию на апрель 2014 г.
Soars NA, Leis JM (2010) Личиночное развитие обыкновенной пони-рыбы, Leiognathus equulus (Teleostei: Leiognathidae). Ichthyol Res 57: 263–271
Stevens EG, Watson W., Moser HG (1989) Развитие и распространение личинок и пелагической молоди трех кифозидных рыб ( Girella nigricans, Medialuna californiensis, и Hermosilla azurea) Калифорния и Нижняя Калифорния.Fish Bull 87: 745–768
Tanaka Y, Yamada K, Shirafuji T., Nakamura A (2007) Размножение и выращивание стрекозы, Neopomacentrus azysron , в аквариуме. Bull Inst Oceanic Res Develop Tokai Univ 28: 65–77
Thresher RE (1984) Размножение рифовых рыб. TFH Publications, Neptune
Tucker DW (1954) Отчет о рыбах, собранных С.Ю. Розаура в Северной и Центральной Атлантике, 1937–38. Часть IV. Семейства Carcharhinidae, Torpedinidae, Rosauridae (нов.), Salmonidae, Alepocephalidae, Searsidae, Clupeidae. Bull British Mus (Natl Hist) 2: 163–214
Tyler JC, Johnson GD, Nakamura I, Collette BB (1989) Морфология Luvarus imperialis (Luvaridae) с филогенетическим анализом Acanthuroidei (Pisces) . Smithson Contrib Zool 485: 1–77
Uchida K, Imai S, Mito S, Fujita S, Ueno M, Shojima Y, Senta T, Tahuku M, Dotu Y (1958) Исследования яиц, личинок и молоди Японские рыбы. Серия I.Вторая лаборатория биологии рыболовства, кафедра рыболовства, факультет сельского хозяйства, Университет Кюсю, Фукуока
Ватаначай С.Н. (1974) Идентификация икры и личинок рыб, полученных в ходе исследовательских круизов в Южно-Китайском море. Proc. Индо-Тихоокеанский совет рыбаков 15: 111–130
Victor BC (2014) Фотографический гид по личинкам рифовых рыб [Карибского бассейна]. http://www.coralreeffish.com/. По состоянию на апрель 2014 г.
Victor BC (в печати) Сколько существует видов рыб, обитающих на коралловых рифах? Загадочное разнообразие и новая молекулярная таксономия.В: Mora C (ed) Экология рыб на коралловых рифах. Cambridge University Press, Кембридж
Victor BC, Hanner R, Shivji M, Hyde J (2009) Идентификация личиночной и ювенильной стадий Cubera Snapper, Lutjanus cyanopterus с использованием штрих-кодирования ДНК. Zootaxa 2215: 24–36
Whitfield AK (1998) Биология и экология рыб в устьях южной части Африки. JLB Smith Inst Ichthyol, Ichthyol Monog 2: 1–223
Winterbottom R (1986) Обзор: Онтогенез и систематика рыб.Bull Mar Sci 39: 141–143
Yokoyama K, Kamei Y, Toda M, Hirano K, Iwatsuki Y (1994) Репродуктивное поведение, яйца и личинки рыбы Caesionine, Pterocaesio digramma , наблюдаемые в аквариуме. Jpn J Ichthyol 41: 261–274
Zhang J, Huang L, Huo H (2004) Идентификация личинок Lutjanus Bloch в коралловых рифах Нанша молекулярным методом AFLP. J Exp Mar Biol Ecol 298: 3–20
Zhang R, Lu S, Zhao C, Chen L, Zang Z, Zhang X (1985) Икра и личинки рыб в прибрежных водах Китая.Шанхайская научно-техническая пресса, Шанхай
Страница не найдена | Офис научных публикаций
— Любые -MFR 82 (1-2), 2020MFR 81 (3-4), 2019MFR 81 (2), 2019MFR 81 (1), 2019MFR 80 (4), 2018MFR 80 (3), 2018MFR 80 (2), 2018MFR 80 (1), 2018MFR 79 (3-4), 2017MFR 79 (2), 2017MFR 79 (1), 2017MFR 78 (3-4), 2016MFR 78 (1-2), 2016MFR 77 (4), 2015MFR 77 ( 3), 2015MFR 77 (2), 2015MFR 77 (1), 2015MFR 76 (4), 2014MFR 76 (3), 2014MFR 76 (1-2), 2014MFR 75 (4), 2013MFR 75 (3), 2013MFR 75 ( 1-2), 2013MFR 74 (4), 2012MFR 74 (3), 2012MFR 74 (2), 2012MFR 74 (1), 2012MFR 73 (4), 2011MFR 73 (3), 2011MFR 73 (2), 2011MFR 73 ( 1), 2011MFR 72 (4), 2010MFR 72 (3), 2010MFR 72 (2), 2010MFR 72 (1), 2010MFR 71 (4), 2009MFR 71 (3), 2009MFR 71 (2), 2009MFR 71 (1) , 2009MFR 70 (3-4), 2008MFR 70 (2), 2008MFR 70 (1), 2008MFR 69 (1-4), 2007MFR 68 (1-4), 2006MFR 67 (4), 2005MFR 67 (3), 2005MFR 67 (2), 2005MFR 67 (1), 2005MFR 66 (4), 2004MFR 66 (3), 2004MFR 66 (2), 2004MFR 66 (1), 2004MFR 65 (4), 2003MFR 65 (3), 2003MFR 65 ( 2), 2003MFR 65 (1), 2003MFR 64 (4), 2002MFR 64 (3), 2002MFR 64 (2), 2002MFR 64 (1), 2002MFR 63 (4), 2001MFR 63 (3), 2001MFR 63 (2) , 2001МФР 63 (1), 2001МФР 62 (4), 20 00MFR 62 (3), 2000MFR 62 (2), 2000MFR 62 (1), 2000MFR 61 (4), 1999MFR 61 (3), 1999MFR 61 (2), 1999MFR 61 (1), 1999MFR 60 (4), 1998MFR 60 (3), 1998MFR 60 (2), 1998MFR 60 (1), 1998MFR 59 (4), 1997MFR 59 (3), 1997MFR 59 (2), 1997MFR 59 (1), 1997MFR 58 (4), 1996MFR 58 (3) ), 1996MFR 58 (1-2), 1996MFR 57 (3-4), 1995MFR 57 (2), 1995MFR 57 (1), 1995MFR 56 (4), 1994MFR 56 (3), 1994MFR 56 (2), 1994MFR 56 (1), 1994MFR 55 (4), 1993MFR 55 (3), 1993MFR 55 (2), 1993MFR 55 (1), 1993MFR 54 (4), 1992MFR 54 (3), 1992MFR 54 (2), 1992MFR 54 (1) ), 1992MFR 53 (4), 1991MFR 53 (3), 1991MFR 53 (2), 1991MFR 53 (1), 1991MFR 52 (4), 1990MFR 52 (3), 1990MFR 52 (2), 1990MFR 52 (1), 1990MFR 51 (4), 1989MFR 51 (3), 1989MFR 51 (2), 1989MFR 51 (1), 1989MFR 50 (4), 1988MFR 50 (3), 1988MFR 50 (2), 1988MFR 50 (1), 1988MFR 49 (4), 1987MFR 49 (3), 1987MFR 49 (2), 1987MFR 49 (1), 1987MFR 48 (4), 1986MFR 48 (3), 1986MFR 48 (2), 1986MFR 48 (1), 1986MFR 47 (4) ), 1985MFR 47 (3), 1985MFR 47 (2), 1985MFR 47 (1), 1985MFR 46 (4), 1984MFR 46 (3), 1984MFR 46 (2), 1984MFR 46 (1), 1984MFR 45 (10-12 ), 1983 г. MFR 45 (7-9), 1983MFR 45 (4-6), 1983MFR 45 (3), 1983MFR 45 (2), 1983MFR 45 (1), 1983MFR 44 (12), 1982MFR 44 (11), 1982MFR 44 (8) ), 1982MFR 44 (6-7), 1982MFR 44 (5), 1982MFR 44 (4), 1982MFR 44 (3), 1982MFR 44 (2), 1982MFR 44 (1), 1982MFR 44 (9-10), 1982MFR 43 (12), 1981MFR 43 (11), 1981MFR 43 (10), 1981MFR 43 (9), 1981MFR 43 (8), 1981MFR 43 (7), 1981MFR 43 (6), 1981MFR 43 (5), 1981MFR 43 (4 ), 1981MFR 43 (3), 1981MFR 43 (2), 1981MFR 43 (1), 1981MFR 42 (12), 1980MFR 42 (11), 1980MFR 42 (9-10), 1980MFR 42 (7-8), 1980MFR 42 (6), 1980MFR 42 (5), 1980MFR 42 (3-4), 1980MFR 42 (2), 1980MFR 42 (1), 1980MFR 41 (12), 1979MFR 41 (11), 1979MFR 41 (10), 1979MFR 41 (9), 1979MFR 41 (8), 1979MFR 41 (7), 1979MFR 41 (5-6), 1979MFR 41 (4), 1979MFR 41 (3), 1979MFR 41 (1-2), 1979MFR 40 (12), 1978MFR 40 (11), 1978MFR 40 (10), 1978MFR 40 (9), 1978MFR 40 (8), 1978MFR 40 (7), 1978MFR 40 (5-6), 1978MFR 40 (4), 1978MFR 40 (3), 1978 MFR 40 (2), 1978 MFR 40 (1), 1978 MFR 39 (12) MFR 39 (11) MFR 39 (10) MFR 39 (9) MFR 39 (8) MFR 39 (7) MFR 39 (6) MFR 39 ( 5) MFR 39 (4) MFR 39 (3) MFR 39 (2) MFR 39 (1) MFR 38 (12) MFR 38 (11) MFR 38 (10) MFR 38 (9) MFR 38 (8) MFR 38 (7) MFR 38 (6) MFR 38 (5) MFR 38 (4) MFR 38 (3) MFR 38 (2) MFR 38 (1) MFR 37 (12) MFR 37 (11) MFR 37 (10) MFR 37 (9) MFR 37 (8) MFR 37 (7) MFR 37 (5-6) MFR 37 (4) MFR 37 (3) MFR 37 (2) MFR 37 (1) MFR 36 (12) MFR 36 (11) MFR 36 (10) MFR 36 (9) MFR 36 (8) MFR 36 (7) MFR 36 (6) MFR 36 (5) MFR 36 (4) MFR 36 (3) MFR 36 (2) MFR 36 (1) MFR 35 (12) MFR 35 (11) MFR 35 (10) MFR 35 (9) MFR 35 (8) MFR 35 (7) MFR 35 (5-6) MFR 35 (3-4) MFR 35 (1-2) MFR 34 (11-12) MFR 34 (9-10) MFR 34 (7-8) MFR 34 (5-6) MFR 34 (3-4) MFR 34 (1-2) MFR 33 (11-12) MFR 33 (10) MFR 33 (9) MFR 33 (7- 8) MFR 33 (6) MFR 33 (5) MFR 33 (4) MFR 33 (3) MFR 33 (2) MFR 33 (1) MFR 32 (12) MFR 32 (11) MFR 32 (10) MFR32 (8) -9) MFR 32 (7) MFR 32 (6) MFR 32 (5) MFR 32 (4) MFR 32 (3) MFR 32 (2) MFR 32 (1) MFR 31 (12) MFR 31 (11) MFR 31 (10) MFR 31 (8-9) MFR 31 (7) MFR 31 (6) MFR 31 (5) MFR 31 (4) MFR 31 (3) MFR 31 (2) MFR 31 (1) MFR 30 (12) MFR 30 (11) MFR 30 (10) MFR 30 (8-9) MFR 30 (7) MFR 30 (6) MFR 30 (5) MFR 30 (4) MFR 30 (3) MFR 30 (2) MFR 30 ( 1) М FR 29 (12) MFR 29 (11) MFR 29 (10) MFR 29 (8-9) MFR 29 (7) MFR 29 (6) MFR 29 (5) MFR 29 (4) MFR 29 (3) MFR 29 ( 2) MFR 29 (1) MFR 28 (12) MFR 28 (11) MFR 28 (10) MFR 28 (9) MFR 28 (8) MFR 28 (7) MFR 28 (6) MFR 28 (5) MFR 28 ( 4) MFR 28 (3) MFR 28 (2) MFR 28 (1) MFR 27 (12) MFR 27 (11) MFR 27 (10) MFR 27 (9) MFR 27 (8) MFR 27 (7) MFR 27 ( 6) MFR 27 (5) MFR 27 (4) MFR 27 (3) MFR 27 (2) MFR 27 (1) MFR 26 (12) MFR 26 (11a) MFR 26 (11) MFR 26 (10) MFR 26 ( 9) MFR 26 (8) MFR 26 (7) MFR 26 (6) MFR 26 (5) MFR 26 (4) MFR 26 (3) MFR 26 (2) MFR 26 (1) MFR 25 (12) MFR 25 ( 11) MFR 25 (10) MFR 25 (9) MFR 25 (8) MFR 25 (7) MFR 25 (6) MFR 25 (5) MFR 25 (4) MFR 25 (3) MFR 25 (2) MFR 25 ( 1) MFR 24 (12) MFR 24 (11) MFR 24 (10) MFR 24 (9) MFR 24 (8) MFR 24 (7) MFR 24 (6) MFR 24 (5) MFR 24 (4) MFR 24 ( 3) MFR 24 (2) MFR 24 (1) MFR 23 (12) MFR 23 (11) MFR 23 (10) MFR 23 (9) MFR 23 (8) MFR 23 (7) MFR 23 (6) MFR 23 ( 5) MFR 23 (4) MFR 23 (3) MFR 23 (2) MFR 23 (1) MFR 22 (12) MFR 22 (11) MFR 22 (10) MFR 22 (9) MFR 22 (8) MFR 22 ( 7) MFR 22 (6) MFR 22 (5) MFR 22 (4) MFR 22 (3) MFR 22 (2) MFR 22 (1) MFR 21 (12) MF R 21 (11) MFR 21 (10) MFR 21 (9) MFR 21 (8) MFR 21 (7) MFR 21 (6) MFR 21 (5) MFR 21 (4) MFR 21 (3) MFR 21 (2a) MFR 21 (2) MFR 21 (1) MFR 20 (12) MFR 20 (11a) MFR 20 (11) MFR 20 (10) MFR 20 (9) MFR 20 (8) MFR 20 (7) MFR 20 (6) MFR 20 (5) MFR 20 (4) MFR 20 (3) MFR 20 (2) MFR 20 (1) MFR 19 (12) MFR 19 (11) MFR 19 (10) MFR 19 (9) MFR 19 (8) MFR 19 (7) MFR 19 (6) MFR 19 (5a) MFR 19 (5) MFR 19 (4a) MFR 19 (4) MFR 19 (3) MFR 19 (2) MFR 19 (1) MFR 18 (12) MFR 18 (11) MFR 18 (10) MFR 18 (9) MFR 18 (8) MFR 18 (7) MFR 18 (6) MFR 18 (5) MFR 18 (4) MFR 18 (3) MFR 18 (2) MFR 18 (1) MFR 17 (12) MFR 17 (11) MFR 17 (10) MFR 17 (9) MFR 17 (8) MFR 17 (7) MFR 17 (6) MFR 17 (5) MFR 17 (4) MFR 17 (3) MFR 17 (2) MFR 17 (1) MFR 16 (12) MFR 16 (11) MFR 16 (10) MFR 16 (9) MFR 16 (8) MFR 16 (7) MFR 16 (6) MFR 16 (5) MFR 16 (4) MFR 16 (3) MFR 16 (2) MFR 16 (1) MFR 15 (12) MFR 15 (11) MFR 15 (10) MFR 15 (9) MFR 15 (8) MFR 15 (7) MFR 15 (6) MFR 15 (5) MFR 15 (4) MFR 15 (3) MFR 15 (2) MFR 15 (1) MFR 14 (12) MFR 14 (12a) MFR 14 (11) MFR 14 (10) MFR 14 (9) MFR 14 (8) MFR 14 (7) MFR 14 (6) MFR 14 (5) MFR 14 (4) M FR 14 (3) MFR 14 (2) MFR 14 (1) MFR 13 (12) MFR 13 (11a) MFR 13 (11) MFR 13 (10) MFR 13 (9) MFR 13 (8) MFR 13 (7) MFR 13 (6) MFR 13 (5) MFR 13 (4) MFR 13 (3) MFR 13 (2) MFR 13 (1) MFR 12 (12) MFR 12 (11a) MFR 12 (11) MFR 12 (10) MFR 12 (9) MFR 12 (8) MFR 12 (7) MFR 12 (6) MFR 12 (5) MFR 12 (4) MFR 12 (3) MFR 12 (2) MFR 12 (1) MFR 11 (12) MFR 11 (11) MFR 11 (10) MFR 11 (9) MFR 11 (8) MFR 11 (7) MFR 11 (6) MFR 11 (5) MFR 11 (4) MFR 11 (3) MFR 11 (2) MFR 11 (1) MFR 10 (12) MFR 10 (11) MFR 10 (10) MFR 10 (9) MFR 10 (8) MFR 10 (7) MFR 10 (6) MFR 10 (5) MFR 10 (4) MFR 10 (3) MFR 10 (2) MFR 10 (1) MFR 9 (12) MFR 9 (11) MFR 9 (10) MFR 9 (9) MFR 9 (8) MFR 9 (7) MFR 9 (6) MFR 9 (5) MFR 9 (4) MFR 9 (3) MFR 9 (2) MFR 9 (1) MFR 8 (12) MFR 8 (11a) MFR 8 (11) MFR 8 (10) MFR 8 (9) MFR 8 (8) MFR 8 (7) MFR 8 (6) MFR 8 (5) MFR 8 (4) MFR 8 (3) MFR 8 (2) MFR 8 (1)
BBC — Земля — 12 гнезд, которые вы не поверите, были сделаны насекомыми
Муравей-ткачиха ( Oecophylla smaragdina )
Этот муравей плетет гнездо из листьев дерева высоко в кроне деревьев.Чтобы построить один, группа рабочих формирует живые муравьиные мостики, чтобы собрать вместе листья, в то время как другой собирает личинок из существующего муравейника.
Рабочие муравьи держат этих личинок в челюстях и сжимают их, перемещаясь по краям листа. При выдавливании личинка муравья-ткача производит тонкое шелковое волокно, склеивающее листья. По мере того, как тянется все больше и больше листьев, образуется комок свежих зеленых листьев, выстланный белым шелковым матом.
Повреждения гнезда от сильного ветра и увядания листьев означают, что рабочие муравьи должны строить еще много подобным образом.Эти крошечные муравьи-ткачи доминируют над всем кроном дерева, прежде чем перейти к следующему.
Пчела-каменщик ( Osmiaavensetta )
Найдя подходящее место для гнездования, пчела-каменщик выкапывает нору на несколько сантиметров глубиной в рыхлой почве. Здесь он строит первый, внешний слой своего трехслойного гнезда, используя лепестки, которые он вырывает из цветов по соседству. Затем он промазывает лепестки изнутри влажной землей.
Оставляя почву сохнуть, он собирается собрать больше лепестков, чтобы выстилать свое вазообразное гнездо, в конечном итоге создавая сэндвич из почвы между лепестками.После того, как она накормила гнездо пищей, самка откладывает яйцо.
Перед уходом она закрывает вход, складывая выступы внутреннего слоя лепестков, покрывая их землей и, наконец, складывая внешние лепестки.
Лепестки цветов не только удерживают влагу для развивающейся личинки, но и защищают гнездо от затопления. Воздух, попавший в гнездо, удерживает его на плаву в случае наводнения, а затвердевшая ильная облицовка спасает его от раздавливания или нападения хищников.
Восточная палаточная гусеница ( Malacosoma americanum )
Этот вид моли назван в честь шатровых гнезд, которые строят ее гусеницы.
Когда яйца вылупляются ранней весной, температура воздуха еще низкая. Так, на деревьях собирается до 300 появляющихся гусениц, чтобы сплести шелковый шатер. Днем температура в палатке выше, чем в окружающей среде, что, в свою очередь, повышает температуру тела каждой гусеницы, улучшая ее метаболизм.
Палатка сделана из тонких слоев шелка с использованием веток деревьев в качестве точек крепления. Он расширяется от трех до четырех раз в день на всех стадиях развития личинки, кроме последней (или шестой), которая сохраняет свой шелк, чтобы плести кокон. Точки выхода и входа сохранены там, где из палатки торчат ветки.
Когда гусеницам нужно кормиться, они объединяются, путешествуя к местам кормления и обратно, используя визуальные и химические сигналы.
Термит Spinifex ( Nasutitermes triodiae )
Широко известный как соборный термит, этот вид обитает на спинифексах или кочковых лугах Австралии.Он строит из песка и глины огромные соборные гнезда-курганы.
Миллионы термитов, питающихся травой, могут жить в одном холме, массивном сооружении, иногда весом более 10 тонн. Курганы различаются по форме от колонии к колонии: у них могут быть тупые или заостренные вершины, а также гладкий или выпуклый вид.
Солдаты охраняют колонию от нападения хищников, распыляя защитные химические вещества из кончика удлиненной трубки, называемой «нос»: это дало этому виду другое название — термит-назуте . Противомикробные соединения в секретах солдат также могут защитить колонию от паразитов.
Муравей-акробат ( Crematogaster видов)
Муравьи-акробаты, известные своим приподнятым животом в форме сердца при угрозе, живут и гнездятся на деревьях.
Они делают гнезда из картонных коробок сфероидальной формы, смешивая пережеванные растения с почвой. Гнезда могут быть размером от теннисного мяча до футбольного мяча. Они часто строятся на ветках, но иногда также на ветвях и стволах деревьев.
Сначала выбранные веточки накидывают одинарным слоем картона. Затем поверх него добавляются последовательные слои.
В последнем гнезде есть несколько камер, которые связаны между собой крошечными проходами. Внешние камеры добавляются в направлении вниз и наружу, что делает гнездо водонепроницаемым и придает ему вид пагоды. Известно, что рыжий дятел откладывает яйца в активных гнездах муравьев-акробатов.
Грязевая мазь для органной трубы ( Trypoxylon politum )
Грязевые осы гнездятся на скалах, стенах и мостах с легким доступом к грязи.Они гнездятся на гладких вертикальных поверхностях, защищенных от солнечного света и дождя.
Чтобы сделать его, самка осы формирует из грязи трубу и разделяет ее на несколько «выводковых камер». Там она откладывает яйца и запасает несколько маленьких или несколько больших пауков, чтобы их съели молодые.
Перед тем, как собрать грязь, самка проверяет ее консистенцию ртом; она проверяет довольно много источников, прежде чем остановиться на одном. Когда она довольна, она делает выпад с раздвинутыми челюстями и зачерпывает немного грязи.Затем, передав его на передние лапы, она снова делает выпад, черпает еще немного и, наконец, улетает с грузом.
С каждой порцией грязи, принесенной после этого, она делает полосу, начинающуюся посередине, продвигая ее вниз, чтобы встретить поверхность. Полоса на одной стороне чередуется с полосой на другой. Получающееся в результате гнездо имеет вид перевернутой V-образной полосы с внешней стороны; изнутри сделана гладкой.
Самец охраняет гнездо, пока самка строит его, а когда она уезжает, собирает пищу для пауков для своих будущих детей.
Оса-костяной домик ( Deuteragenia ossarium )
Полостное гнездо этой паукообразной осы имеет несколько камер или ячеек, в каждой из которых самка откладывает яйцо. Каждая ячейка отделена тонкой стенкой почвы и снабжена парализованным пауком, который может съесть появляющаяся личинка.
Но прежде чем самка покидает гнездо, она строит крайнюю камеру и заполняет ее мертвыми муравьями. Запах муравьев маскирует личинок и куколок, развивающихся внутри, и спасает их от хищников и паразитов, которые ищут хозяев по запаху.
Один конкретный вид муравьев, Pachycondyla astuta , обычно используется осой. Этот большой и агрессивный муравей имеет неприятный укус, а его запах отпугивает хищников даже в мертвом состоянии.
«Оса-костяной дом» была обнаружена в Китае и впервые описана в 2014 году. Когда ученые впервые увидели ее гнездо, они подумали об исторических костных домах или оссуариях, где хранились человеческие кости — отсюда и название.
Маленькая коричневая бумажная оса ( Ropalidia Revolutionalis )
Также известный как австралийская бумажная оса, этот вид строит гнезда, напоминающие крошечные флейты.
Гнездится колониями с несколькими гребнями, построенными близко друг к другу. Каждый гребень состоит из двух рядов ячеек, свисающих с ветки на крошечном стебле. Осы производят эти клетки, смешивая гниющую древесину со слюной.
Колония основана группой самок. Первый гребень, который они делают, большой; гребни меньшего размера, называемые сателлитами, добавляются позже. Чтобы структура оставалась прохладной при высоких температурах, самки обмахивают соты крыльями. И самцы, и самки защищают гнездо от злоумышленников, а приносящие пищу стучат головой перед тем, как отдать ее личинкам.
Клоп луговой ( Philaenus leucophthalmus или spumarius )
Нимфы клопа живут в пенистой массе «слюны», которую они выпускают из анального отверстия.
Вскоре после того, как они вылупятся весной, нимфы отправляются искать место на луговом растении, затененном от солнечного света и ветра. Через несколько минут после кормления соками растений нимфы начинают выделять слюну.
Для этого они сначала выделяют анальную жидкость, которая прилипает к их телу и частично погружается в нее.Затем, перемещая сегменты своего живота, они захватывают воздух в канал и, сжимаясь, вдувают его в эту жидкость, чтобы образовались пузырьки.
Нимфы линяют и превращаются во взрослых особей в самой пенной ванне, время от времени оставляя их кормиться. Во время последней линьки они перестают давать слюну и дают высохнуть своему гнезду.
Пчела-листорез ( Megachile centuncularis )
Пчела-листорезка гнездится в существующих полостях в древесине или норках в почве.
Используя свои челюсти как ножницы, он разрезает круглые или овальные листовые диски, которыми выстилает отдельные ячейки своего гнезда. После того, как каждая ячейка построена, пчела запасает ее пыльцой и кладет на нее яйцо.
Когда первая ячейка готова, гнездо закрывает ее круглыми пластинчатыми дисками. Эта перегородка образует основу следующей клетки, и пчела повторяет процесс, пока несколько не будут готовы. Наконец, он забивает вход в гнездо большим количеством листьев.
Для создания одной ячейки может потребоваться около 10 часов, включая перерывы на обед, 21 поездку для сбора листового материала — предпочтительно с растения розы — и 18 поездок для накопления корма.
Caddisfly ( Limnephilus rhombicus )
Личинки этого ручейника, обитающие в стоячих или медленно протекающих водах с густой подводной растительностью в Северной Америке и Европе, строят себе особую оболочку, чтобы избежать хищников.
Личинка создаст толстую трубчатую оболочку из веток и корней водных растений и закроет ее раковинами улиток. Он цементирует это сырье, используя шелк, который он прядет, чтобы сформировать твердое защитное покрытие.
Личинка может волочить это покрывало, высовываясь наружу.

